题目内容
4.聚乙烯醇(PVA)的性能和外观与天然蚕丝非常相似,主要用于织成各种棉纺植物,他的合成路线如图: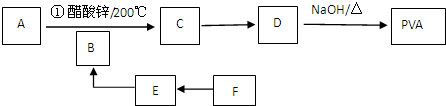
已知:A是一种无色无味气体,在工业上特别用于烧焊金属,B和F是常见的调味剂.
(1)写出C中含有的官能团名称酯基、碳碳双键,①的反应类型是加成反应.
(2)写出E转化为B的化学方程式2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH.
(3)写出D转化为PVA的化学方程式
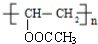 +n NaOH→
+n NaOH→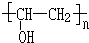 +n CH3COONa.
+n CH3COONa.(4)写出与C的官能团相同的C的同分异构体,CH2=CHCOOCH3,HCOOCH=CHCH3,CH2=C(CH3)OOCH,HCOOCH2CH=CH2.
分析 A是一种无色无味气体,在工业上特别用于烧焊金属,则A为HC≡CH,B和F是常见的调味剂,F转化得到E,E转化得到B,则F为CH3CH2OH、B为CH3CHO、B为CH3COOH,乙酸与乙炔反应生成C,C转化得到D,D在氢氧化钠条件下得到聚乙烯醇,则乙酸与乙炔发生加成反应生成C为CH2=CHOOCCH3,C发生加聚反应生成D为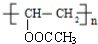 ,D发生水解反应生成PVA(
,D发生水解反应生成PVA(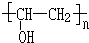 ),据此解答.
),据此解答.
解答 解:A是一种无色无味气体,在工业上特别用于烧焊金属,则A为HC≡CH,B和F是常见的调味剂,F转化得到E,E转化得到B,则F为CH3CH2OH、E为CH3CHO、B为CH3COOH,乙酸与乙炔反应生成C,C转化得到D,D在氢氧化钠条件下得到聚乙烯醇,则乙酸与乙炔发生加成反应生成C为CH2=CHOOCCH3,C发生加聚反应生成D为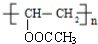 ,D发生水解反应生成PVA(
,D发生水解反应生成PVA(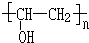 ).
).
(1)C为CH2=CHOOCCH3,含有的官能团名称:酯基、碳碳双键,①的反应类型是:加成反应,
故答案为:酯基、碳碳双键;加成反应;
(2)E转化为B的化学方程式为:2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH,故答案为:2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH;
(3)D转化为PVA的化学方程式: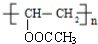 +n NaOH→
+n NaOH→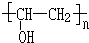 +n CH3COONa,
+n CH3COONa,
故答案为: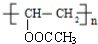 +n NaOH→
+n NaOH→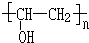 +n CH3COONa;
+n CH3COONa;
(4)与C(CH2=CHOOCCH3)的官能团相同的C的同分异构体:CH2=CHCOOCH3,HCOOCH=CHCH3,CH2=C(CH3)OOCH,HCOOCH2CH=CH2
故答案为:CH2=CHCOOCH3,HCOOCH=CHCH3,CH2=C(CH3)OOCH,HCOOCH2CH=CH2.
点评 本题考查有机物推断,关键是根据D在氢氧化钠条件下得到聚乙烯醇判断乙炔与乙酸发生加成反应,需要学生熟练掌握官能团的性质与转化,难度中等.

 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ/mol.
(2)2NH3(g)?N2(g)+3H2(g)在恒容密闭容器中达到平衡的标志有:C.
①单位时间内生成3n mol H2同时生成2n mol NH3
②用NH3、N2、H2表示反应速率比为2:1:3
③混合气体的密度不再改变
④混合气体压强不再改变
⑤混合气体平均相对分子质量不再改变
A.①③④B.①②④⑤C.①④⑤D.②③④
(3)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象.保持其它条件不变,则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).
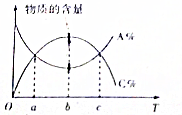 对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )
对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )| A. | 该反应为吸热反应 | |
| B. | 在a,c时刻,正逆反应速率相等 | |
| C. | 若横轴为压强,则存在m+n<p | |
| D. | b时刻正逆反应速率大于c时刻的正逆反应速率 |
| A. | 往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| D. | 实验室可以用浓硫酸与氯化钠固体共热制取氯化氢气体,因此浓硫酸与碘化钠固体共热也能制取碘化氢气体 |
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 配制480mL 2mol/L的NaOH溶液 | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
| B | 测定中和热 | 烧杯、玻璃棒、纸板、保温塑料、温度计 | 50mL0.5mol/LNaOH溶液与50mL0.5mol/L盐酸 |
| C | 测定生成H2速率 | 分液漏斗、锥形瓶、针筒、铁架台 | Zn粒、稀硫酸 |
| D | 浓硫酸脱水性 | 分液漏斗、试管 | 蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
 在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )| A. | 反应的平均速率v(A)=0.04 mol/(L•min) | |
| B. | 达平衡时A、B的转化率相等 | |
| C. | 向平衡混合物中再加入0.1 mol A、0.2 mol B,达新平衡时C的体积分数减小 | |
| D. | 若升高温度达新平衡后,A的浓度增大,则△H>0 |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |