题目内容
6.某研究小组将CaCl2和H2在一定条件下反应,制得两种化合物(甲和乙).元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性.请回答下列问题:(1)甲的电子式是
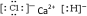 .
.(2)工业制备乙溶液的方法是(用文字叙述)氢气在氯气中燃烧制备氯化氢,溶于水得到盐酸.
在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是2Cl-+MnO2+4H+△_Mn2++Cl2↑+2H2O.
乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是保持FeCl2溶液呈酸性,并加入铁粉防止氧化.
(3)甲与乙溶液反应可得H2,其化学方程式是CaHCl+HCl=CaCl2+H2↑.反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2•xH2O.为确定x的值,请设计实验方案:取一定质量的晶体于试管中加水溶解,加入足量的硝酸银溶液,过滤洗涤干燥称量得到氯化银的质量,根据晶体的质量和氯化银的质量两个数据可计算求得x值.
分析 化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%,还有一种元素,根据反应中元素守恒知,另一种元素为氢元素,则其钙原子、氯原子和氢原子个数之比=52.3640:46.3335.5:1−52.361=1:1:1,化合物乙的水溶液显酸性,则为氯化氢,工业用氢气在氯气中燃烧制备氯化氢,二氧化锰和浓盐酸反应制备氯气,
解答 解:化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%,还有一种元素,根据反应中元素守恒知,另一种元素为氢元素,则其钙原子、氯原子和氢原子个数之比=52.3640:46.3335.5:1−52.361=1:1:1,化合物乙的水溶液显酸性,则为氯化氢,
(1)甲为CaHCl,电子式为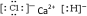 ,故答案为:
,故答案为: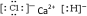 ;
;
(2)工业用氢气在氯气中燃烧制备氯化氢,溶于水得到盐酸,
氧化锰和浓盐酸之间加热反应可以生成氯化锰、水以及氯气,实质是:2Cl-+MnO2+4H+△_Mn2++Cl2↑+2H2O,氯化亚铁易被氧化为氯化铁,加入铁粉防止氧化,并且氯化亚铁易水解,应保持FeCl2溶液呈酸性.
故答案为:氢气在氯气中燃烧制备氯化氢,溶于水得到盐酸;2Cl-+MnO2+4H+△_Mn2++Cl2↑+2H2O;保持FeCl2溶液呈酸性,并加入铁粉防止氧化;
(3)甲与乙溶液反应可得H2,其化学方程式是CaHCl+HCl=CaCl2+H2↑,反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2•xH2O.为确定x的值,可取一定质量的晶体于试管中加水溶解,加入足量的硝酸银溶液,过滤洗涤干燥称量得到氯化银的质量,根据晶体的质量和氯化银的质量两个数据可计算求得x值,
故答案为:CaHCl+HCl=CaCl2+H2↑;取一定质量的晶体于试管中加水溶解,加入足量的硝酸银溶液,过滤洗涤干燥称量得到氯化银的质量,根据晶体的质量和氯化银的质量两个数据可计算求得x值.
点评 本题综合考查无机物的推断以及含量的测定实验设计,为高频考点,侧重于学生的分析能力和实验能力的考查,明确物质的性质是解本题关键,性质决定用途,题目难度中等.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案| A. | Na2S | B. | S | C. | S02 | D. | H2SO4 |
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸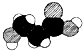 | |
| D. | 化合物 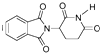 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
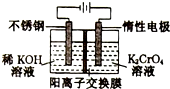 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )| A. | 在阳极室,通电后溶液逐渐由橙色变为黄色 | |
| B. | 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g | |
| C. | 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d |
| A. | HClO的结构式:H-Cl-O | |
| B. | NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | 羟基的电子式: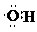 | |
| D. | 异丙醇的结构简式:CH3CH2CH2OH |
| A. | 电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移 | |
| B. | 含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022 | |
| C. | 28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子 | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |

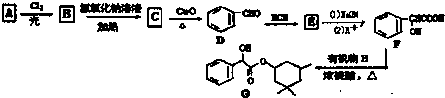
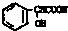
 ,D→E的反应类型为加成反应
,D→E的反应类型为加成反应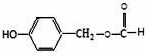
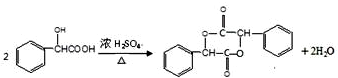
 在一定条件下可以合成一种含三个六元环的有机物(C16H12O4),写出该反应的化学方程式
在一定条件下可以合成一种含三个六元环的有机物(C16H12O4),写出该反应的化学方程式