18.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
16.下列装置或操作能达到实验目的是( )
| A. | 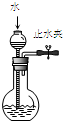 图1所示装置可检查装置气密性 | |
| B. | 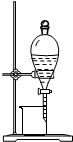 图2所示装置可从碘的CCl4溶液中分离出碘 | |
| C. | 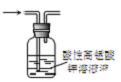 图3所示装置可除去甲烷中乙烯 | |
| D. | 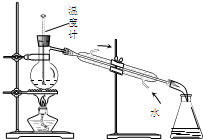 图4所示装置可分离甲苯与乙醇 |
14.下列有关说法正确的是( )
| A. | 马口铁(镀锡铁)镀层受损后,铁制品比受损前更容易生锈 | |
| B. | 2CaCO3(s)+2SO2(g)+O2(g)═2CaSO4(s)+2CO2(g)在高温下能自发进行,则该反应的△H>0 | |
| C. | 恒温恒容密闭容器中进行的反应N2(g)+3H2(g)?2NH3(g);△H=a kJ•mol-1,平衡时向容器中再充入N2和H2,反应速率加快,a值不变 | |
| D. | 氢硫酸(弱酸)中加入少量CuSO4溶液(H2S+CuSO4═CuS↓+H2SO4),H2S的电离程度和溶液的pH均增大 |
12.下列表示正确的是( )
0 168628 168636 168642 168646 168652 168654 168658 168664 168666 168672 168678 168682 168684 168688 168694 168696 168702 168706 168708 168712 168714 168718 168720 168722 168723 168724 168726 168727 168728 168730 168732 168736 168738 168742 168744 168748 168754 168756 168762 168766 168768 168772 168778 168784 168786 168792 168796 168798 168804 168808 168814 168822 203614
| A. | 含有大量AlO2-的溶液中:K+、NH4+、Br-、HSO3-可以大量共存 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ•mol-1 | |
| C. | 将少量SO2通入NaClO溶液中:2ClO-+SO2+H2O═SO32-+2HClO | |
| D. | 在某钠盐溶液中含等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但未见沉淀生成,则原溶液中一定有NO3-、I-和CO32- |

 ,肉桂醛分子结构中有6种不同化学环境的氢原子.
,肉桂醛分子结构中有6种不同化学环境的氢原子.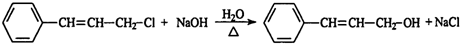 ,B转化为肉桂醛的反应条件为Cu/Ag加热.
,B转化为肉桂醛的反应条件为Cu/Ag加热. .
. .
.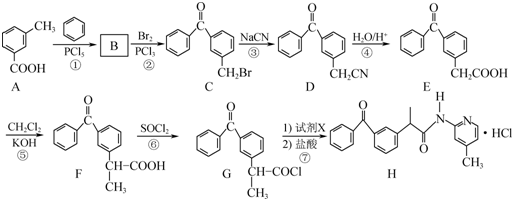
 +
+ $\stackrel{PCl_{3}}{→}$
$\stackrel{PCl_{3}}{→}$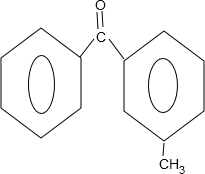 +H2O.
+H2O.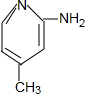 .
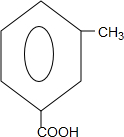
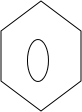
.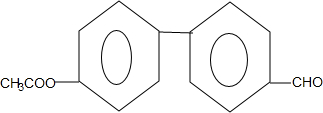 (只写一种).
(只写一种).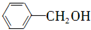 和
和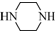 为原料制备
为原料制备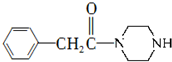 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).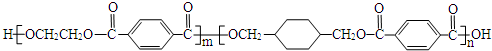
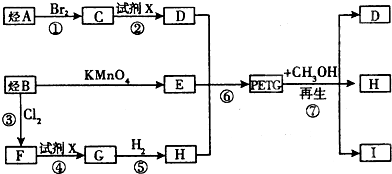
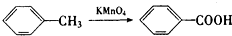

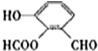
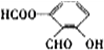 、
、 、
、
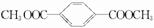 .
.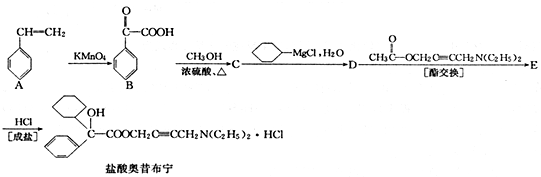
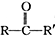 +
+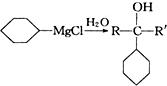 请回答下列问题
请回答下列问题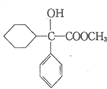 .
.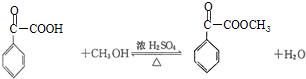 ,属取代反应.
,属取代反应.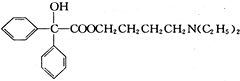 互为同分异构体
互为同分异构体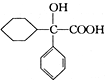 可发生缩聚反应.
可发生缩聚反应.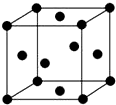 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.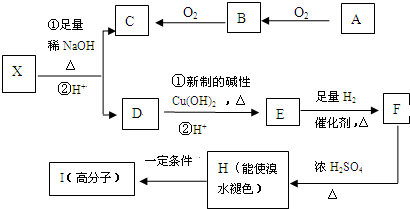
 ;
;