题目内容
10. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B形成的化合物B2A2分子中σ键和π键数目之比为3:2;B、C、D三种元素的第一电离能由大到小的排列顺序为N>O>C,电负性由大到小的顺序为O>N>C.
(2)M与N分子结构的相同点是①.
①中心原子杂化方式 ②共价键键角 ③分子极性 ④立体构型
(3)X和Y分别是B、C的某种氢化物,这两种氢化物都含有18电子,X和Y的化学式分别是C2H6、N2H4,两者沸点的关系为X<Y(“>”或“>”),原因是N2H4分子间有氢键,C2H6分子间是范德华力.
(4)在E形成的羰基配合物离子E(CO)n2+中,中心原子提供的价电子数与配体提供的电子总数之和为16,则n=7.
(5)金属E的晶胞是面心立方结构(如图),则E晶体的1个 晶胞中E原子数为4,E原子的配位数为12.若此晶胞的密度为dg/cm3,阿伏加德罗常数为NA,请用d 和NA来表示此晶胞中两个E原子最近的距离$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{192}{a{N}_{A}}}$.
分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B原子电子排布式为1s22s22p2,故B为碳元素;D原子的核外电子总数是最内层电子总数的4倍,即原子核外电子总数为8,则D为O元素;C的原子序数介于碳、氧之间,故C为氮元素;同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面,则M为HCHO;A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为苯;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,则E的原子序数为18+4=22,则E为Ti元素,据此解得.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B原子电子排布式为1s22s22p2,故B为碳元素;D原子的核外电子总数是最内层电子总数的4倍,即原子核外电子总数为8,则D为O元素;C的原子序数介于碳、氧之间,故C为氮元素;同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面,则M为HCHO;A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为苯;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,则E的原子序数为18+4=22,则E为Ti元素.
(1)A、B形成化合物C2H2分子,结构式为H-C≡C-H,分子中σ键和π键数目之比为3:2;
同周期元素随原子序数增大,元素第一电离能呈增大的趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C;
同周期随原子序数增大,电负性增大,故电负性:O>N>C,
故答案为:3:2;N>O>C;O>N>C;
(2)M为HCHO为平面三角形,N为苯为平面正六边形,甲醛分子中正负电荷重心不重合,为极性分子,苯分子中正负电荷重心重合,为非极性分子,分子中C原子均形成3个σ键,均采取sp2杂化,苯分子呈平面正六边形,6个碳碳键完全相同,键角皆为120°,而甲醛分子不是平面正三角形,键角不是120°,
故答案为:①;
(3)X和Y分别是C、N的某种氢化物,这两种氢化物都含有18电子,则X为C2H6、Y为N2H4,N2H4分子间有氢键,C2H6分子间是范德华力,故沸点:C2H6<N2H4,
故答案为:C2H6、N2H4;<;N2H4分子间有氢键,C2H6分子间是范德华力;
(4)在Ti形成的羰基配合物离子Ti(CO)n2+中,Ti离子提供价电子数为2,CO提供电子为2,则:2+2n=16,解得n=7,
故答案为:7;
(5)金属E的晶胞是面心立方结构,则E晶体的1个 晶胞中E原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,顶点E原子与面心E原子相邻,每个顶点为8个晶胞共用,故E的配位数为$\frac{3×8}{2}$=12,晶胞质量为$\frac{4×48}{{N}_{A}}$g,晶胞的密度为dg/cm3,则晶胞体积为$\frac{4×48}{{N}_{A}}$g÷dg/cm3=$\frac{\sqrt{192}}{d{N}_{A}}$cm3,则晶胞棱长为$\root{3}{\frac{192}{a{N}_{A}}}$cm,故晶胞中两个E原子最近的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{192}{a{N}_{A}}}$cm,
故答案为:4;12;$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{192}{a{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、电负性、化学键、分子结构、氢键、配合物、晶胞计算等,基本是对物质结构的主干知识进行综合考查,需要学生具备扎实的基础,难度中等.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案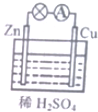
| A. | 原电池的反应本质是氧化还原反应 | B. | 电子由Cu片通过导线流向锌片 | ||
| C. | 正极反应式为Zn-2e=Zn2+ | D. | Cu为负极,Zn为正极 |
| A. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 除去乙烷中混有的乙烯的方法是通氢气在一定条件下反应,使乙烯转化为乙烷 |
| A. | 漂粉精 | B. | 生石灰 | C. | 过氧化钠 | D. | 亚硫酸钠 |
| A. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” | |
| B. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 | |
| C. | pH计也可用于酸碱中和滴定终点的判断 | |
| D. | 海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” |
| A. | 阳极材料也可以是Cu | |
| B. | 阴极每产生3molH2,则有1mol Cr2O72-被还原 | |
| C. | 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀 |

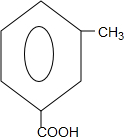 +
+ $\stackrel{PCl_{3}}{→}$
$\stackrel{PCl_{3}}{→}$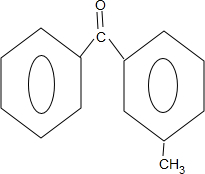 +H2O.
+H2O.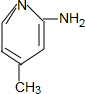 .
.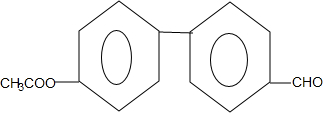 (只写一种).
(只写一种).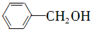 和
和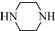 为原料制备
为原料制备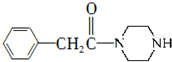 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).