题目内容
14.下列有关说法正确的是( )| A. | 马口铁(镀锡铁)镀层受损后,铁制品比受损前更容易生锈 | |
| B. | 2CaCO3(s)+2SO2(g)+O2(g)═2CaSO4(s)+2CO2(g)在高温下能自发进行,则该反应的△H>0 | |
| C. | 恒温恒容密闭容器中进行的反应N2(g)+3H2(g)?2NH3(g);△H=a kJ•mol-1,平衡时向容器中再充入N2和H2,反应速率加快,a值不变 | |
| D. | 氢硫酸(弱酸)中加入少量CuSO4溶液(H2S+CuSO4═CuS↓+H2SO4),H2S的电离程度和溶液的pH均增大 |
分析 A、镀锡铁制品镀层破损在潮湿的空气中形成原电池,铁做负极被腐蚀;
B、反应自发进行的判断依据是△H-T△S<0;
C、增大反应物浓度,反应速率加快;焓变仅与系数成正比与平衡状态无关;
D、根据反应H2S+CuSO4═CuS↓+H2SO4,H2S的电离程度增大,溶液的pH减小.
解答 解:A、镀锡铁制品镀层破损在潮湿的空气中形成原电池,铁做负极被腐蚀,所以铁制品比受损前更容易生锈,故A正确;
B、2CaCO3(s)+2SO2(g)+O2(g)═2CaSO4(s)+2CO2(g)在高温下能自发进行,△H-T△S<0,反应△S<0,说明该反应的△H<0,故B错误;
C、因为增大反应物浓度,反应速率加快,焓变仅与系数成正比与平衡状态无关,所以反应N2(g)+3H2(g)?2NH3(g);△H=a kJ•mol-1,平衡时向容器中再充入N2和H2,反应速率加快,a值不变,故C正确;
D、由反应H2S+CuSO4═CuS↓+H2SO4得出,H2S的电离程度增大,溶液的pH减小,故D错误;
故选AC.
点评 本题考查了反应热量变化,自发进行的判断依据,原电池原理应用,平衡移动原理的分析判断,题目难度中等.

练习册系列答案
相关题目
4.NH5属于离子化合物,与水反应的化学方程式为:NH5+H2O=NH3.H2O+H2↑,有关NH5叙述正确的是( )
| A. | NH5的电子式: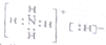 | |
| B. | NH5中N元素的化合价为+5价 | |
| C. | 1molNH5中含有5molN-H键 | |
| D. | 1molNH5与H2O完全反应,转移电子2mol |
19.下列说法正确的是( )
| A. | 银氨溶液可用于检验淀粉是否发生水解 | |
| B. | 植物油的主要成分是高级脂肪酸 | |
| C. | 蔗糖及其水解产物均可发生银镜反应 | |
| D. | 鸡蛋清溶液中加入饱和硫酸钠溶液,生成的沉淀物不能再溶解 |
6.下列有关实验的叙述正确的是( )
| A. | 将一定量的氯气通入30 mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系,n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 | |
| B. | 实验室可以配制一种仅含Al3+、K+、SO42-、NO3-这4种离子(不考虑来源于水电离的离子)的溶液,且4种离子的浓度均为1mol/L | |
| C. | HCl、FeCl3、Fe3O4、NaOH都可通过置换反应一步得到也可通过化合反应一步得到 | |
| D. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
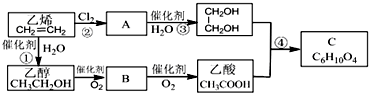
3.能源是现代化社会生活的物质基础.背景材料:①2006年国际油价飙升,新型纳米金属燃料面世;②2005、2006年全国许多省市全面推广使用乙醇汽油;③2010年,江苏省打造成全国重要的太阳能产业基地;④生物柴油是以油脂为原料,通过水解、酯化得高级脂肪酸甲酯(含C、H、O元素).下列说法正确的是( )
| A. | 乙醇汽油推广的最主要的目的在于降低国际市场的油料价格 | |
| B. | 生物柴油燃烧不会产生二氧化碳,是一种清洁能源 | |
| C. | 太阳能是一种清洁安全的不可再生能源 | |
| D. | 纳米金属燃料表面积大,易引发,能量释放快 |
4.短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,金属铝能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| X | Y | |
| W | Q |
| A. | Y的最高化合价为+6 | B. | 简单离子的半径:W>Q>Y>X | ||
| C. | 氢化物的稳定性:W>Y | D. | 最高价氧化物的水化物的酸性:W<Q |
 已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:D>C>B,第一电离能:C>D>B,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出H2.G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍.
已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:D>C>B,第一电离能:C>D>B,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出H2.G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍.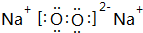 .它与F2D3按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为2Na2O2+2Al2O3=4NaAlO2+O2↑.
.它与F2D3按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为2Na2O2+2Al2O3=4NaAlO2+O2↑.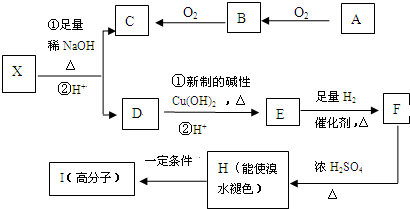
 ;
;