题目内容
16.下列装置或操作能达到实验目的是( )| A. | 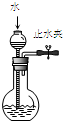 图1所示装置可检查装置气密性 | |
| B. | 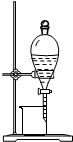 图2所示装置可从碘的CCl4溶液中分离出碘 | |
| C. | 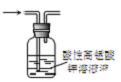 图3所示装置可除去甲烷中乙烯 | |
| D. | 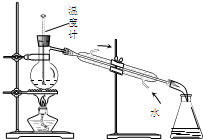 图4所示装置可分离甲苯与乙醇 |
分析 A.关闭止水夹,利用液差法可检验气密性;
B.从碘的CCl4溶液中分离出碘,选择蒸馏法;
C.乙烯被氧化生成二氧化碳,引入新杂质;
D.蒸馏时测定馏分的温度.
解答 解:A.由图可知,关闭止水夹,从长颈漏斗注入水,当烧瓶内液面与长颈漏斗导管中液面的高度在一段时间保持不变,可说明气密性良好,故A正确;
B.从碘的CCl4溶液中分离出碘,选择蒸馏法,不能利用图中分液装置分离,故B错误;
C.乙烯被氧化生成二氧化碳,引入新杂质,不能除杂,应选溴水、洗气除杂,故C错误;
D.蒸馏时测定馏分的温度,则温度计的水银球应在烧瓶的支管口处,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及气密性的检验及混合物分离提纯等,把握物质的性质、混合物分离提纯方法及实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
6.甲、乙、丙、丁4位同学分别设计了如下4个实验说明影响化学反应快慢的因素,结论不正确的是( )
| A. | 将浓硝酸分别放在冷暗处和强光照射卞,会发现光照可以加快浓硝酸的分解 | |
| B. | 将形状、大小均相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样 | |
| C. | 在相同条件下,等质量的大理石块和大理石粉末与相同浓度的盐酸反应,大理石粉末反应快 | |
| D. | 两只试管中分别加入相同质量的氯酸钾,其中一只试管中再加入少量二氧化锰,同时加热,加入二氧化锰的试管中产生氧气快 |
7.能源与人类的生活和社会发展密切相关,下列关于能源开发和利用的说法中,你认为说法不正确的是( )
| A. | 充分利用太阳能 | |
| B. | 因地制宜开发利用风能、水能、地热能、潮汐能 | |
| C. | 合理、安全开发利用氢能、核能 | |
| D. | 煤的汽化与液化不能提高燃料燃烧效率 |
4.常温下,下列有关叙述正确的是( )
| A. | 0.1 mol•L-1 pH为4的KHC2O4溶液中:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| C. | 向0.1mol/L的Na2S溶液中通入H2S至溶液呈中性(忽略体积变化),则溶液中:c(HS-)+2c(S2-)=0.2mol/L | |
| D. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
1.从下列事实所得出的相应结论正确的是( )
| 实 验 事 实 | 结 论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| C | 将Na2CO3溶液与苯酚浊液混合溶液变澄清 | 酸性:苯酚>HCO3- |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| A. | A | B. | B | C. | C | D. | D |
8.下列图示与叙述正确的是( )
| A. | 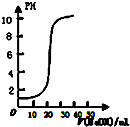 表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线 | |
| B. | 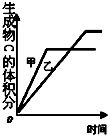 表示压强对可逆反应2A (g)+B (g)?3C (g)+D (s)的影响且甲的比乙的压强大 | |
| C. | 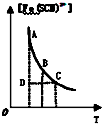 表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓度[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) | |
| D. | 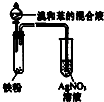 所示装置可证明溴与苯发生取代反应 |
5.下列化合物中既存在离子键,又存在非极性键的是( )
| A. | H2O | B. | NH4Cl | C. | NaOH | D. | Na2O2 |
6.硫酸锰是工业上制备二氧化锰活性电极的原料,用软锰矿浊液吸收空气中的SO2,得到的硫酸锰溶液中含有CuSO4、Fe2(SO4)3杂质,向溶液中加入MnCO3,充分反应过滤;再加入MnS,充分反应后过滤,可以得到碱性的硫酸锰溶液.已知常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp(CuS)=6.3×10-36,Ksp(MnS)=4.65×10-14.下列推断不正确的是( )
| A. | 加入MnCO3的目的是除去Fe3+ | |
| B. | 常温下,pH=4时,Fe3+已除尽 | |
| C. | 反应Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=1.35×1022 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
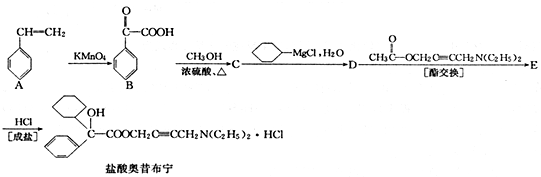
 +
+ 请回答下列问题
请回答下列问题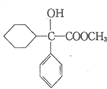 .
.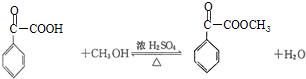 ,属取代反应.
,属取代反应.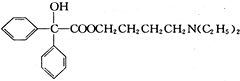 互为同分异构体
互为同分异构体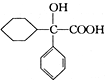 可发生缩聚反应.
可发生缩聚反应.