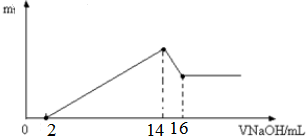
4.已知常温下,0.1mol•L-1 CH3COONH4溶液呈中性.下列有关叙述正确的是( )
| A. | 该溶液可由等体积、浓度均为0.1mol•L-1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加人纯水中,水的电离程度不变 | |
| C. | 常温下,电离平衡常数K(CH3COOH)=K(NH3•H2O) | |
| D. | 该溶液中c(CH3COO-)大于同浓度CH3COONa溶液中的c(CH3COO-) |
3.下列各组离子,在指定环境中能大量共存的是( )
| A. | 在碱性溶液中,Na+、S2-、K+、AlO2- | |
| B. | 在酸性溶液中,SO32-、S2-、K+、NH4+ | |
| C. | 在酸性溶液中,Fe2+、Cu2+、Cl-、NO3- | |
| D. | 在酸性溶液中,Fe2+、Cl-、Na+、SO42- |
20.常温下,下列说法正确的是( )
| A. | 0.1mol•L-1 的硫酸溶液中NH4+、Fe2+、Cl-、NO3-可以共存 | |
| B. | 向Ba(OH)2 溶液中滴入硫酸溶液的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| C. | 0.1mol•L-1 AlCl3 溶液,温度从20℃升高到50℃,所有离子浓度均增大 | |
| D. | pH=11的NaOH 溶液中有:[OH-]=[Na+]+[H+] |
16.某课外小组研究Fe3+与I-发生反应的速度关系和平衡移动原理的应用.
(1)写FeCl3溶液和KI溶液的离子方程式:2Fe3++2I-=2Fe2++I2.
(2)在其他条件不变时,上述反应达到平衡后,取2mL,平衡混合物加入2mL苯充分振荡萃取(填操作名称).所看到的实验现象是分层,上层为紫色(浅紫色到紫红色均可),下层接近无色,化学平衡将向正反应方向(或右)移动.
(3)由于Fe3+与I2水的稀溶液颜色接近,肉眼比较难区分上述反应是否发生,如果要看到发生反应则应有的操作及实验现象是取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色.该小组同学希望通过鉴别Fe2+得到目的,取样加入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,生成带有特征蓝色的铁氰化亚铁沉淀.该反应的离子方程式为3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
(4)Fe3+与I-发生反应的正反应速率v与c(Fe3+)和c(I-)的关系为v=kcm(Fe3+)cn(I-)(k为常数)
通过表中数据计算的m=1;n=2.
(5)现有0.10mol•L-1 FeCl3溶液和0.10mol•L-1 KI溶液各2mL在试管中充分反应达到平衡,测得平衡时c(Fe3+)变为0.01mol•L-1,没有碘固体析出,试计算此条件下该反应的平衡常数K=3.2×103.
0 168496 168504 168510 168514 168520 168522 168526 168532 168534 168540 168546 168550 168552 168556 168562 168564 168570 168574 168576 168580 168582 168586 168588 168590 168591 168592 168594 168595 168596 168598 168600 168604 168606 168610 168612 168616 168622 168624 168630 168634 168636 168640 168646 168652 168654 168660 168664 168666 168672 168676 168682 168690 203614
(1)写FeCl3溶液和KI溶液的离子方程式:2Fe3++2I-=2Fe2++I2.
(2)在其他条件不变时,上述反应达到平衡后,取2mL,平衡混合物加入2mL苯充分振荡萃取(填操作名称).所看到的实验现象是分层,上层为紫色(浅紫色到紫红色均可),下层接近无色,化学平衡将向正反应方向(或右)移动.
(3)由于Fe3+与I2水的稀溶液颜色接近,肉眼比较难区分上述反应是否发生,如果要看到发生反应则应有的操作及实验现象是取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色.该小组同学希望通过鉴别Fe2+得到目的,取样加入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,生成带有特征蓝色的铁氰化亚铁沉淀.该反应的离子方程式为3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
(4)Fe3+与I-发生反应的正反应速率v与c(Fe3+)和c(I-)的关系为v=kcm(Fe3+)cn(I-)(k为常数)
| C(Fe3+)/mol•L-1 | c(I-)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.80 | 0.20 | 0.032k |
| ② | 0.40 | 0.60 | 0.144k |
| ③ | 0.20 | 0.80 | 0.128k |
(5)现有0.10mol•L-1 FeCl3溶液和0.10mol•L-1 KI溶液各2mL在试管中充分反应达到平衡,测得平衡时c(Fe3+)变为0.01mol•L-1,没有碘固体析出,试计算此条件下该反应的平衡常数K=3.2×103.