题目内容
19.将某质量的镁铝合金溶解在500mL盐酸中,然后取出10mL溶液用1mol/L NaOH溶液滴定,产生沉淀质量一碱溶液的关系如图,求:(1)合金中镁和铝的物质的量之比;
(2)盐酸的物质的量浓度(假设反应后溶液体积不变)
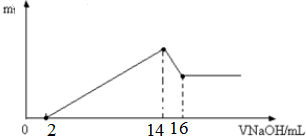
分析 (1)加入NaOH溶液2mL~14mL时,发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,加入NaOH16mL时,发生反应Al(OH)3+NaOH=NaAlO2+2H2O,消耗NaOH溶液2mL,此时n(NaOH)=0.002L×1mol/L=0.002mol,以此可计算Al3+的物质的量,根据结合反应的离子方程式计算镁和铝的质量;
(2)由图象可知,当加入NaOH 14mL时,恰好生成Mg(OH)2和Al(OH)3沉淀,此时溶液溶质为NaCl,以此计算盐酸的物质的量浓度.
解答 解:(1)加入NaOH16mL时,发生反应为:Al(OH)3+NaOH=NaAlO2+2H2O,消耗NaOH溶液2mL,此时n(NaOH)=0.002L×1mol/L=0.002mol,
则n(Al3+)=n[Al(OH)3]=0.002mol,
加入NaOH溶液2mL~14mL时,发生反应:Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,
可知n(Mg2+)×2+n(Al3+)×3=0.012L×1mol/L=0.012mol,
解得:n(Mg2+)=0.003mol,
溶液具有均一性,再结合质量守恒定律可知,合金中镁和铝的物质的量之比为:0.003mol:0.002mol=3:2,
答:合金中镁和铝的物质的量之比为3:2.
(2)由图象可知,当加入NaOH14mL时,沉淀为Mg(OH)2和Al(OH)3,溶液溶质为NaCl,则n(NaCl)=n(NaOH)=0.014L×1moL/L=0.014mol,
则c(HCl)=$\frac{0.014mol}{0.01L}$=1.4mol/L,
溶液具有均一性,则盐酸的浓度为1.4mol/L,
答:盐酸的物质的量浓度为1.4mol/L.
点评 本题以图象题的形式考查镁铝化合物性质、混合物的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,题目难度中等,分析图象各阶段的发生的反应是解题关键,注意利用守恒思想进行计算.

| A. | V(B)=0.6 mol/(L•min) | B. | V(A)=0.3 mol/(L•min) | ||
| C. | V(B)=0.02/(L•S) | D. | V(C)=0.5 mol/(L•min) |
| A. | 含有5个碳原子的烷烃,每个分子中最多可形成5个C-C单键 | |
| B. | 正丁烷中四个碳原子在同一条直线上 | |
| C. | 所有烷烃中都存在碳碳单键 | |
| D. | 二氯甲烷只有一种结构 |
| A. | 油脂制肥皂实验中加一定量的乙醇是为了增加油脂的溶解,加快反应速率 | |
| B. | 油脂制肥皂实验中加一定量的饱和食盐水为了降低肥皂的溶解度,使肥皂析出 | |
| C. | 反应过程中,混合液是否分层可以判断皂化反应是否完全 | |
| D. | 皂化反应的产物中都有甘油 |
| A. | 该溶液可由等体积、浓度均为0.1mol•L-1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加人纯水中,水的电离程度不变 | |
| C. | 常温下,电离平衡常数K(CH3COOH)=K(NH3•H2O) | |
| D. | 该溶液中c(CH3COO-)大于同浓度CH3COONa溶液中的c(CH3COO-) |
| A. | Fe3+、NO${\;}_{3}^{-}$、SCN-、CO${\;}_{3}^{2-}$ | B. | Fe2+、H+、Cl-、ClO- | ||
| C. | Mg2+、Na+、CH3COO-、SO${\;}_{4}^{2-}$ | D. | Na+、AlO${\;}_{2}^{-}$、Cl-、HCO${\;}_{3}^{-}$ |
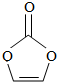
| A. | 分子式为C3H2O3 | B. | 分子中含6个σ键 | ||
| C. | 分子中只有极性键 | D. | 8.6g该物质完全燃烧得到6.72LCO2 |
| A. |  观察Fe(OH)2的生成 观察Fe(OH)2的生成 | |
| B. |  配制一定物质的量浓度的NaNO3溶液 配制一定物质的量浓度的NaNO3溶液 | |
| C. |  实验室制取氨 实验室制取氨 | |
| D. |  验证乙烯的生成 验证乙烯的生成 |