题目内容
20.常温下,下列说法正确的是( )| A. | 0.1mol•L-1 的硫酸溶液中NH4+、Fe2+、Cl-、NO3-可以共存 | |
| B. | 向Ba(OH)2 溶液中滴入硫酸溶液的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| C. | 0.1mol•L-1 AlCl3 溶液,温度从20℃升高到50℃,所有离子浓度均增大 | |
| D. | pH=11的NaOH 溶液中有:[OH-]=[Na+]+[H+] |
分析 A.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子;
B.氢氧化钡与稀硫酸反应生成硫酸钡和水,漏掉了生成水的反应;
C.升高温度,铝离子的水解程度增大,铝离子浓度增大;
D.溶液中一定满足电荷守恒,根据电荷守恒进行判断.
解答 解:A.Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.硫酸与氢氧化钡反应生成硫酸钡和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.0.1mol•L-1 AlCl3 溶液,温度从20℃升高到50℃,铝离子的水解程度增大,则溶液中铝离子浓度减小,故C错误;
D.pH=11的NaOH溶液中,根据电荷守恒可得:[OH-]=[Na+]+[H+],故D正确;
故选D.
点评 本题考查了离子共存、离子方程式的书写、离子浓度大小比较等知识,题目难度中等,试题知识点较多、充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握离子共存、离子方程式的判断方法,明确判断离子浓度大小的方法.

练习册系列答案
相关题目
10.若1mol某气态烃CxHy完全燃烧,需用5molO2,则( )
| A. | x=2,y=2 | B. | x=2,y=4 | C. | x=3,y=6 | D. | x=3,y=8 |
11.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| D. | 1 mol的甲基与1 mol的铵根离子所含电子数均为10NA |
8.在同温同压下,某有机物和过量Na反应得到V1 L氢气,另一份等量的该有机物和足量的NaHCO3反应得到V2 L二氧化碳,若V1=V2≠0,则该有机物可能是( )
| A. |  | B. | HOOC-COOH | C. | HOCH2CH2OH | D. | CH3COOH |
15. 金刚烷(C10H16)的结果如图所示,它可以看成四个等同的六元环组成的空间构型.该金刚烷的二氯代物的数目是( )
金刚烷(C10H16)的结果如图所示,它可以看成四个等同的六元环组成的空间构型.该金刚烷的二氯代物的数目是( )
 金刚烷(C10H16)的结果如图所示,它可以看成四个等同的六元环组成的空间构型.该金刚烷的二氯代物的数目是( )
金刚烷(C10H16)的结果如图所示,它可以看成四个等同的六元环组成的空间构型.该金刚烷的二氯代物的数目是( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
9.下列有关NaClO和NaCl混合溶液的叙述正确的是( )
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H20 | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
10.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如图反应制备,下列叙述错误的是( )
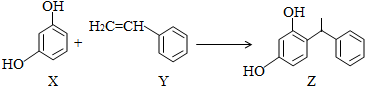

| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能发生取代反应,也能发生加成反应 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |