题目内容
5.设NA表示阿伏伽德罗常数的值,下列说法中正确的是①②④.①17.6g丙烷中所含的共价键数为4NA;
②常温下,21g C3H6和C4H8的混合物中含有的碳原子数为1.5NA;
③电解饱和食盐水,当阴极产生2.24L H2时,转移的电子数为0.2NA;
④2g D216O中含有的质子数、中子数、电子数均为NA;
⑤常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA;
⑥将100mL 0.1mol•L-1的FeCl3溶液滴入沸水中可制的Fe(OH)3胶粒0.01NA.
分析 ①17.6g丙烷物质的量为0.4mol,每摩尔丙烷中含有共价键10mol;
②C3H6和C4H8的最简式为CH2,根据最简式计算出混合物中含有的碳原子数;
③不一定是在标准状况下;
④依据n=$\frac{m}{M}$计算物质的量,再计算微粒数;
⑤氢氧化钠电离出氢氧根离子,抑制水的电离;
⑥胶体微粒是氢氧化铁的集合体.
解答 解:①17.6g丙烷物质的量为$\frac{17.6g}{44g/mol}$=0.4mol,每摩尔丙烷中含有共价键10mol,所以0,4mol丙烷含共价键为0.4mol×10=4mol,即4NA,故①正确;
②常温下,21g C3H6和C4H8的混合物中含有最简式CH2的物质的量为$\frac{21g}{14g/mol}$=1.5mol,故含有的碳原子数为1.5mol,即1.5NA,故②正确;
③不一定在标准状况下,2.24L H2不一定是0.1mol,故③错误;
④依据2gD216O的物质的量=$\frac{2g}{20g/mol}$=0.1mol,故所含有的质子数为0.1mol×10=1mol,即NA个;含有的中子数为0.1mol×10=1mol,即NA个;含有的电子数为0.1mol×10=1mol,即NA个,故④正确;
⑤常温下,pH=13的NaOH溶液中,含有的OH-数目为0.1mol,即0.1NA,氢氧化钠电离出氢氧根离子抑制水的电离,故由水电离的OH-离子数目远小于0.1NA,故⑤错误;
⑥胶体微粒是氢氧化铁的集合体,将100mL0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒小于0.01NA.故⑥错误;
故说法中正确的是:①②④.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 有些活泼金属,如铝可作还原剂法的还原剂 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
| A. | 0.1mol•L-1 的硫酸溶液中NH4+、Fe2+、Cl-、NO3-可以共存 | |
| B. | 向Ba(OH)2 溶液中滴入硫酸溶液的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| C. | 0.1mol•L-1 AlCl3 溶液,温度从20℃升高到50℃,所有离子浓度均增大 | |
| D. | pH=11的NaOH 溶液中有:[OH-]=[Na+]+[H+] |
| A. | 5% | B. | 9.1% | C. | 10.5% | D. | 15% |
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25mL0.1mol•L-1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的25mL0.1mol•L-1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | 生成白色沉淀 |

实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)3SO2+2H2O+2NO3-=2NO+4H++3SO42-.
(3)验证假设二
请设计实验验证假设二,写出实验步骤、预期现象和结论.
| 实验步骤、预期现象和结论(不要求写具体操作过程): |
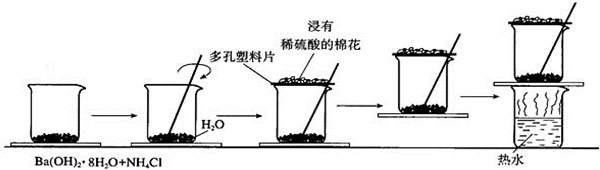
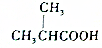 的官能团为-COOH;在0.1mol/L该酸的水溶液中就1滴酚酞试液,溶液呈无色.
的官能团为-COOH;在0.1mol/L该酸的水溶液中就1滴酚酞试液,溶液呈无色.
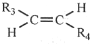 ,则T的结构简式为
,则T的结构简式为 .
.