题目内容
16.某课外小组研究Fe3+与I-发生反应的速度关系和平衡移动原理的应用.(1)写FeCl3溶液和KI溶液的离子方程式:2Fe3++2I-=2Fe2++I2.
(2)在其他条件不变时,上述反应达到平衡后,取2mL,平衡混合物加入2mL苯充分振荡萃取(填操作名称).所看到的实验现象是分层,上层为紫色(浅紫色到紫红色均可),下层接近无色,化学平衡将向正反应方向(或右)移动.
(3)由于Fe3+与I2水的稀溶液颜色接近,肉眼比较难区分上述反应是否发生,如果要看到发生反应则应有的操作及实验现象是取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色.该小组同学希望通过鉴别Fe2+得到目的,取样加入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,生成带有特征蓝色的铁氰化亚铁沉淀.该反应的离子方程式为3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
(4)Fe3+与I-发生反应的正反应速率v与c(Fe3+)和c(I-)的关系为v=kcm(Fe3+)cn(I-)(k为常数)
| C(Fe3+)/mol•L-1 | c(I-)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.80 | 0.20 | 0.032k |
| ② | 0.40 | 0.60 | 0.144k |
| ③ | 0.20 | 0.80 | 0.128k |
(5)现有0.10mol•L-1 FeCl3溶液和0.10mol•L-1 KI溶液各2mL在试管中充分反应达到平衡,测得平衡时c(Fe3+)变为0.01mol•L-1,没有碘固体析出,试计算此条件下该反应的平衡常数K=3.2×103.
分析 (1)Fe3+具有氧化性,I-具有还原性,二者可发生氧化还原反应生成Fe2+和I2,据此写出反应的离子方程式;
(2)碘单质在有机溶剂苯中的溶解度较大,在水中溶解度较小,加入苯振荡后发生萃取现象,下层几乎为无色,上层为紫色;由于溶液中碘单质较小,则平衡向着正向移动;
(3)淀粉遇到碘单质显示蓝色,据此进行检验;产生特征蓝色沉淀的离子反应方程式是:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓;
(4)将表中的三组数据代入公式v=kcm(Fe3+)cn(I-)(k为常数)得m和n的值;
(5)根据反应方程式计算出达到平衡时各组分的浓度,然后结合化学平衡常数表达式及反应2Fe3++2I-=2Fe2++I2进行计算.
解答 解:(1)Fe3+具有氧化性,I-具有还原性,二者可发生氧化还原反应生成Fe2+和I2,反应的离子方程式为:2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2;
(2)2mL平衡混合物加入2mL苯充分振荡,苯要萃取平衡混合物中的I2,由于苯的密度比水小,故上层是溶有I2的苯,为紫色,下层溶液中I2的量减小,平衡向正反应方向移动,
故答案为:萃取;分层,上层为紫色(浅紫色到紫红色均可),下层接近无色;正反应方向(或右);
(3)Fe3+和I2水的稀溶液颜色接近,根据碘单质遇到淀粉显示蓝色,可加入淀粉溶液,操作方法及现象为:取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色;取样加入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,生成带有特征蓝色的铁氰化亚铁沉淀,该反应的离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓,
故答案为:取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色;3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓
(4)将表中的三组数据代入公式v=kcm(Fe3+)cn(I-)(k为常数)可得:
①0.80m×0.20n=0.032K,
②0.40m×0.60n=0.144K,
③0.20m×0.80n=0.128K,
联立解得:m=1、n=2,
故答案为:1;2;
(5)平衡时c(Fe3+)变为0.01 mol/L,则消耗的铁离子的物质的量为:n(Fe3+)=0.10×2×10-3mol-0.01×4×10-3mol=1.6×10-4mol,
则生成的浓度为:c(Fe2+)=$\frac{1.6×1{0}^{-4}mol}{4×1{0}^{-3}L}$=0.04 mol•L-1,
消耗的碘离子的物质的量为:n(I-)=1.6×10-4mol,
平衡时碘离子的浓度为:c(I-)=?$\frac{0.10×2×1{0}^{-3}mol-1.6×1{0}^{-4}mol}{4×1{0}^{-3}L}$=0.01 mol•L-1,生成碘单质的浓度为:c(I2)=$\frac{\frac{1}{2}×1.6×1{0}^{-4}mol}{4×1{0}^{-3}L}$=0.02mol/L,
再由化学平衡常数公式及反应2Fe3++2I-=2Fe2++I2可知:K=$\frac{0.0{4}^{2}×0.02}{0.0{1}^{2}×0.0{1}^{2}}$=3.2×103,
故答案为:3.2×103.
点评 本题考查化学反应速率的影响、化学平衡及化学平衡常数的计算,题目难度中等,注意掌握化学反应速率及其影响,明确化学平衡、化学平衡常数的计算方法,试题培养了学生的分析能力及化学计算能力.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 5.6L | B. | 11.2L | C. | 16.8L | D. | 22.4L |
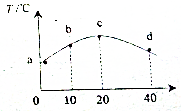 若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(NO2-)+c(HNO2) | |
| C. | c点混合溶液中:c(Na+)>c(OH-)>c(NO2)>c(H+) | |
| D. | d点混合溶液中:c(OH-)=c(HNO2)+c(H+) |

(1)传统上该转化通过如图1所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H<0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
③下列措施中,有利于提高αHCl的有BD.
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 烧结粘土制陶瓷 | D. | 打磨磁石制指南针 |
 和
和  :KMnO4(H+)溶液
:KMnO4(H+)溶液 ,CCl4和乙醇:水.
,CCl4和乙醇:水.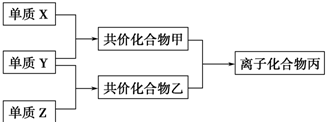
 ;
;