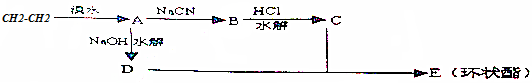题目内容
2.(1)取等质量的乙醇和乙酸的混合物,分别与过量的金属钠和碳酸氢钠完全反应,生成气体的物质的量之比为3:1,则原混合物中乙醇和乙酸的质量之比为23:6;(2)已知某物质A中含碳、氢、氧三种元素中的两种或三种,现取一定质量的A完全燃烧,若燃烧产物被碱石灰完全吸收,碱石灰增重了6.2g,若将燃烧产物与足量的过氧化钠作用,得到2.24L(标准状况下)气体,请回答下列问题:
①物质A分子中的原子必须符合C、H原子数之比为1:2;
②若A是纯净物,则A可以是(填物质的名称,至少填三种)乙烯、甲醛、甲酸等;
③若A在常温常压下是等体积的两种气体的混合物,其可能的组合是(至少填三组)乙烯与丙烯、甲烷与乙炔、乙烷与乙炔.
分析 (1)乙醇和乙酸都与钠反应,乙醇不与碳酸氢钠反应,设出二者的物质的量,然后根据生成气体的物质的量之比列式计算出二者的物质的量之比,然后再计算出二者的质量之比;
(2)①碱金属增重的为燃烧生成水和二氧化碳的总质量,与过氧化钠生成的气体为氧气,是二氧化碳、水与过氧化钠反应生成的,设出水和二氧化碳的物质的量,分别根据总质量、生成气体的物质的量列式计算,从而得出A分子中C、H原子数之比;
②写出C、H分子数之比为1:2的有机物名称;
③只要混合气体中C、H原子数之比为1:2即可,如乙烯与丙烯、甲烷与丙炔等.
解答 解:(1)设乙醇的物质的量为x、乙酸的物质的量为y,与过量的钠反应生成氢气的物质的量为:(x+y),乙醇不与碳酸氢钠反应,乙酸与碳酸氢钠反应生成二氧化碳的物质的量为y,则:(x+y):y=3:1,解得:x:y=5:1,原混合物中乙醇和乙酸的质量之比为:(46×5):(60×1)=23:6,
故答案为:23:6;
(2)①碱石灰增重的为二氧化碳和水的质量,设二氧化碳的物质的量为x,水的物质的量为y,则44x+18y=6.2;二氧化碳、水都与过氧化钠反应生成氧气,标况下2.24L氧气的物质的量为:=0.1mol,则二氧化碳和水的总物质的量为0.2mol,即:x+y=0.2,联立解得:x=0.1mol、y=0.1mol,
所以A分子中C、H原子数之比为1:2,
故答案为:C、H原子数之比为1:2;
②若A是纯净物,则A可以是单烯烃,如:乙烯、丙烯等,若为烃的衍生物,可以为饱和一元醛、饱和一元羧酸,如:甲醛、乙醛、甲酸、乙酸等,
故答案为:乙烯、甲醛、甲酸等;
③若A在常温常压下是两种气体的混合物,必须满足C、H原子数为1:2的气体,其可能的组合为:任意比组成的乙烯与丙烯,或按照1:1混合的甲烷与乙炔,或物质的量相等的乙烷与乙炔,
故答案为:乙烯与丙烯;甲烷与乙炔;乙烷与乙炔.
点评 本题考查了有机物分子数的确定、混合物反应的计算,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | 100KJ | B. | 60KJ | C. | 50KJ | D. | 30KJ |
| A. | 苯与浓溴水用铁作催化剂制溴苯 | B. | 将苯与浓硝酸混合加热制硝基苯 | ||
| C. | 加入水后分液可除去溴苯中的溴 | D. | 可用分液漏斗分离硝基苯和水 |
①CH3CH2OH ②CH3CH2CH2CH2OH ③
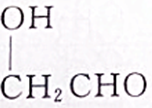 ④
④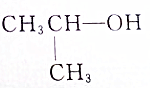
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
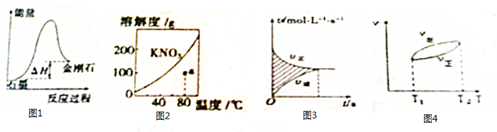
| A. | 由图1可知,从能量角度考虑,金刚石比石墨更稳定 | |
| B. | 图2中a点降温后加入KNO3 固体都能转变成饱和溶液 | |
| C. | 图3中阴影部分的面积表示△v=v正-v逆 | |
| D. | 由图4可知,正反应△H>0 |
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.6 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
| A. | A | B. | B | C. | C | D. | D |
CO(g)+H2S(g)?COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
| A. | 升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |