7.下列有关化学能与热能的说法正确的是( )
| A. | 酸与碱发生中和反应所放出的热量称为中和热 | |
| B. | 若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应 | |
| C. | H2→H+H的变化需要吸收能量 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
6.某主族元素R的最高正化合价与负化合价代数和为6,下列叙述正确的是( )
| A. | R的最高价氧化物为RO3 | B. | R一定是第ⅦA族元素 | ||
| C. | R的气态氢化物能燃烧 | D. | R的气态氢化物易溶于水显碱性 |
5. 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
已知:C(s)+O2(g)?CO2(g)△H=-393kJ•mol-1;
2CO (g)+O2(g)?2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放热(填“吸热”或“放热”)反应.
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.8mol/(L•min).
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注.
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,
还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 $\frac{\underline{\;通电\;}}{\;}$2CO+O2,若阳
极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3.
 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.已知:C(s)+O2(g)?CO2(g)△H=-393kJ•mol-1;
2CO (g)+O2(g)?2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.8mol/(L•min).
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注.
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,
还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 $\frac{\underline{\;通电\;}}{\;}$2CO+O2,若阳
极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3.
4.根据下表信息回答以下问题(均为短周期元素):
(1)在下表中用元素符号标出A、B、C、F的位置
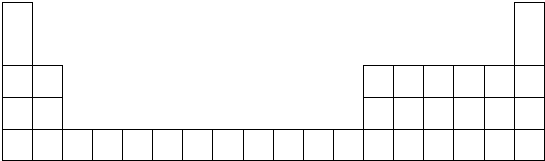
(2)C、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Be(OH)2+2H+═Be2++2H2O.
(3)F在E中燃烧的化学反应方程式:4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O
(4)设计简单试管实验证明D元素与H元素的非金属性强弱关系:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
| 元素 | A | B | C | D | E | F | G | H |
| 原子半径(nm) | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 | 0.152 | 0.037 | 0.099 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1,-1 | +7,-1 |

(2)C、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Be(OH)2+2H+═Be2++2H2O.
(3)F在E中燃烧的化学反应方程式:4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O
(4)设计简单试管实验证明D元素与H元素的非金属性强弱关系:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
3.工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2•6H2O晶体,其工艺流程为:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等).
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.当pH=5时,溶液中c(Fe3+)=2.6×10-12 mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39).检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却.

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.当pH=5时,溶液中c(Fe3+)=2.6×10-12 mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39).检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却.
1.现有部分短周期元素的性质或原子结构如表:
完成下列问题:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)元素Y的氢化物的化学式是:NH3.该氢化物可与该元素的最高价氧化物的水化物生成盐,该盐中的化学键类型是离子键、共价键.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与NaOH溶液反应
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中有一种和其他三种不属于同一类别,该化合物是H2CO3、理由是碳酸是弱酸,其它酸为强酸.
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性, |
| Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)元素Y的氢化物的化学式是:NH3.该氢化物可与该元素的最高价氧化物的水化物生成盐,该盐中的化学键类型是离子键、共价键.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与NaOH溶液反应
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中有一种和其他三种不属于同一类别,该化合物是H2CO3、理由是碳酸是弱酸,其它酸为强酸.
20.如表为元素周期表中的一部分,列出10种元素在周期表中的位置.用化学符号回答下列各题.
(1)10种元素中,化学性质最不活泼的是Ar.
(2)②③④三种元素形成的离子中,离子半径由大到小的顺序是K+>Ca2+>Mg2+.
(3)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(4)元素⑦的氢化物的化学式为H2O;该氢化物常温下和②单质反应的化学方程式是2K+2H2O=2KOH+H2↑;若该氢化物和元素⑧的单质反应,则化学方程式为Cl2+H2O=HCl+HClO.
(5)⑨的最高价氧化物对应水化物的化学式为HBrO4;①和⑨两元素形成化合物为NaBr;该化合物灼烧时火焰颜色为黄色;该化合物的溶液与元素⑧的单质反应的离子方程式为2Br-+Cl2═2Cl-+Br2.
(6)①和⑤元素最高价氧化物对应水化物相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
族 周期 | ||||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)②③④三种元素形成的离子中,离子半径由大到小的顺序是K+>Ca2+>Mg2+.
(3)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(4)元素⑦的氢化物的化学式为H2O;该氢化物常温下和②单质反应的化学方程式是2K+2H2O=2KOH+H2↑;若该氢化物和元素⑧的单质反应,则化学方程式为Cl2+H2O=HCl+HClO.
(5)⑨的最高价氧化物对应水化物的化学式为HBrO4;①和⑨两元素形成化合物为NaBr;该化合物灼烧时火焰颜色为黄色;该化合物的溶液与元素⑧的单质反应的离子方程式为2Br-+Cl2═2Cl-+Br2.
(6)①和⑤元素最高价氧化物对应水化物相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
19.下列离子化合物中,阴、阳离子的电子层结构相同的是( )
| A. | NaCl | B. | LiCl | C. | MgO | D. | Na2S |
18.下列物质中,化学键类型(离子键、共价键)完全相同的是( )
0 168444 168452 168458 168462 168468 168470 168474 168480 168482 168488 168494 168498 168500 168504 168510 168512 168518 168522 168524 168528 168530 168534 168536 168538 168539 168540 168542 168543 168544 168546 168548 168552 168554 168558 168560 168564 168570 168572 168578 168582 168584 168588 168594 168600 168602 168608 168612 168614 168620 168624 168630 168638 203614
| A. | HI和NaI | B. | NaF和NaOH | C. | Na2SO4和KNO3 | D. | F2和NaCl |