题目内容
3.工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2•6H2O晶体,其工艺流程为:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.当pH=5时,溶液中c(Fe3+)=2.6×10-12 mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39).检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却.
分析 冶炼锌废渣中加入硝酸、通入空气酸浸过滤后得到滤液含有Zn2+、Fe3+、Fe2+(少量)、Cu2+、Al3+,在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将未被氧化的Fe2+氧化为Fe3+,调节溶液pH使铁离子、铝离子全部沉淀,过滤后滤液中加入锌除去铜离子,过滤得到硫酸锌溶液,经过蒸发浓缩、冷却结晶、过滤洗涤、烘干得到ZnSO4•6H2O晶体.
(1)从温度、浓度、增大接触面积等分析增大反应速率;
(2)过滤操作中使用的玻璃仪器有:漏斗、烧杯、玻璃棒;
(3)H2O2将Fe2+氧化为Fe3+,自身被还原为H2O;
根据离子开始沉淀及沉淀完全的pH选择控制溶液的pH范围;
计算溶液中c(OH-),代入Ksp[Fe(OH)3]计算溶液中c(Fe3+);
利用KSCN溶液检验Fe3+是否存在,判断沉淀是否完全;
(4)Zn与溶液中铜离子反应,除去溶液中的Cu2+;冷却结晶得到Zn(NO3)2•6H2O晶体.
解答 解:冶炼锌废渣中加入硝酸、通入空气酸浸过滤后得到滤液含有Zn2+、Fe3+、Fe2+(少量)、Cu2+、Al3+,在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将未被氧化的Fe2+氧化为Fe3+,调节溶液pH使铁离子、铝离子全部沉淀,过滤后滤液中加入锌除去铜离子,过滤得到硫酸锌溶液,经过蒸发浓缩、冷却结晶、过滤洗涤、烘干得到ZnSO4•6H2O晶体.
(1)适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等)可提高锌的浸出速率,
故答案为:适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等);
(2)过滤操作中使用的玻璃仪器有:漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
(3)H2O2将Fe2+氧化为Fe3+,自身被还原为H2O,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
由表格中的数据可知,氢氧化锌开始沉淀的pH为5.4,氢氧化铝完全沉淀的pH为5.2,氢氧化铁完全沉淀的pH为3.7,则为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4;
当pH=5时,溶液中c(OH-)=10-9 mol•L-1,由c(Fe3+)×c3(OH-)=2.6×10-39,计算可得c(Fe3+)=2.6×10-12 mol•L-1;
检验Fe3+是否沉淀完全的实验操作是:静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe3+沉淀完全,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;5.2~5.4;2.6×10-12 mol•L-1;静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全;
(4)由流程图及离子沉淀的pH,则加入Zn粉的作用除去溶液中的Cu2+,除杂后的溶液加热浓缩后、冷却结晶得到晶体,
故答案为:除去溶液中的Cu2+;冷却结晶.
点评 本题考查制备方案设计、物质的分离提纯、基本操作、对操作及条件控制的分析评价、离子检验、溶度积计算等,关键是对工艺流程的理解,是对学生综合能力的考查,题目难度中等.

| A. | HI和NaI | B. | NaF和NaOH | C. | Na2SO4和KNO3 | D. | F2和NaCl |
| A. | N2: | B. | NH3 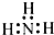 | C. | H2O H+[:O:]2-H+ | D. | NaCl  |
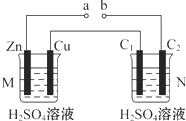
| A. | a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小 | |
| B. | a、b连接,装置M中若有0.1 mol SO42-移到Cu电极,装置N中C2极放出H2 2.24 L(标准状况) | |
| C. | a、b未连接时,装置N中C1电极上有气体析出 | |
| D. | 不论a、b是否连接,装置M中观察到的实验现象相同 |
| A. |  AB2 | B. |  EF2 | C. |  XY3Z | D. |  AB3 |
 B.
B. C.甲醇 D.CH3-O-CH3E.HO-CH2CH2-OH
C.甲醇 D.CH3-O-CH3E.HO-CH2CH2-OH 2-甲基-6-乙基壬烷
2-甲基-6-乙基壬烷 4,7,7-三甲基-1-辛烯
4,7,7-三甲基-1-辛烯