题目内容
1.现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性, |
| Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)元素Y的氢化物的化学式是:NH3.该氢化物可与该元素的最高价氧化物的水化物生成盐,该盐中的化学键类型是离子键、共价键.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与NaOH溶液反应
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中有一种和其他三种不属于同一类别,该化合物是H2CO3、理由是碳酸是弱酸,其它酸为强酸.
分析 短周期元素,T元素原子M层上的电子数是原子核外电子层数的2倍,原子有3个电子层,M层上有6个电子,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素,据此解答.
解答 解:短周期元素,T元素原子M层上的电子数是原子核外电子层数的2倍,原子有3个电子层,M层上有6个电子,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素.
(1)由上述分析可知,元素X的一种核素可测定文物年代,这种核素的符号是146C,
故答案为:146C;
(2)元素Y为氮,氢化物的化学式是:NH3,该氢化物可与该元素的最高价氧化物的水化物生成盐为硝酸铵,该盐中的化学键类型是:离子键、共价键,
故答案为:NH3;离子键、共价键;
(3)Z为Cl元素,T为S元素,同周期自左而右非金属性增强,故Cl元素非金属性强于S,
a.物理性质不能说明非金属性强弱,故a错误;
b.氢化物越稳定,中心元素的非金属性越强,故b正确;
c.与氢氧化钠溶液反应不能说明非金属性强弱,如氧气不能与氢氧化钠溶液反应,非金属性O>S,故c错误;
故答案为:Cl;b;
(4)T、X、Y、Z四种元素的最高价氧化物的水化物分别为:H2SO4、H2CO3、HNO3、HClO4,碳酸是弱酸,其它酸为强酸,碳酸明显不同于其他三种,
故答案为:H2CO3;碳酸是弱酸,其它酸为强酸.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题的关键,注意金属性、非金属性强弱不变.

| A. | 按系统命名法: 的名称为3,3,6三甲基4乙基庚烷 的名称为3,3,6三甲基4乙基庚烷 | |
| B. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸 | |
| C. | 能用新制氢氧化铜和NaOH溶液鉴别甘油、葡萄糖溶液、乙酸钠溶液 | |
| D. | 木糖醇( 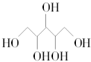 )和葡萄糖( )和葡萄糖(  )互为同系物,均属于糖类 )互为同系物,均属于糖类 |
| A. | CH4+Cl2→CH3Cl+HCl | B. | CH2=CH2+H2O→CH3CH2OH | ||
| C. |  +HO-NO2→ +HO-NO2→ +H2O +H2O | D. | CH3CH2OH→CH2=CH2+H2O |
| A. | 将等物质的量的CH4和Cl2在光照下反应生成纯净的CH3Cl | |
| B. | 将苯与浓硝酸和浓硫酸混合水浴加热制取硝基苯 | |
| C. | 用新制Cu(OH)2悬浊液鉴别葡萄糖和蔗糖 | |
| D. | 用浓硝酸鉴别淀粉溶液和鸡蛋白溶液 |
| A. | R的最高价氧化物为RO3 | B. | R一定是第ⅦA族元素 | ||
| C. | R的气态氢化物能燃烧 | D. | R的气态氢化物易溶于水显碱性 |
| A. | R在周期表的第15列 | |
| B. | 元素Y气态氢化物的沸点小于元素Q气态氢化物的沸点 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
①a=b+5 ②a+b=30 ③a+b=8 ④a-b=8.
| A. | ②③ | B. | ②③④ | C. | ①②③④ | D. | ③④ |
| A. | RO4- | B. | RO3- | C. | RO42- | D. | RO5- |