题目内容
19.下列离子化合物中,阴、阳离子的电子层结构相同的是( )| A. | NaCl | B. | LiCl | C. | MgO | D. | Na2S |
分析 离子化合物中,阴阳离子电子层结构相同,说明阳离子元素位于阴离子元素下一周期,且阴阳离子核外电子数相等,据此分析解答.
解答 解:A.NaCl中钠离子核外有10个电子、Cl离子核外有18个电子,氯离子电子层比钠离子多一个,电子层结构不同,故A错误;
B.LiCl中钠锂离子核外有2个电子、Cl离子核外有18个电子,氯离子电子层比锂离子多2个,电子层结构不同,故B错误;
C.氧化镁中氧离子和镁离子核外电子数都是10,其阴阳离子电子层结构相同,故C正确;
D.Na2S中钠离子核外有10个电子、硫离子核外有18个电子,硫离子比钠离子多1个电子层,电子层结构不同,故D错误;
故选C.
点评 本题考查了原子结构和元素性质,明确原子核外电子排布及原子结构即可解答,电子层结构相同的离子中电子数相等,题目难度不大.

练习册系列答案
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
10.在系统命名法中下列碳原子主链名称是丁烷的是( )
| A. | ( CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH3 |
14.下列说法正确的是( )
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 月桂烯 (  )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 取卤代烃,加入氢氧化钠的乙醇溶液加热一段时间后冷却,再加入稀硝酸酸化的硝酸银溶液,一定会产生沉淀,并根据沉淀颜色判断卤代烃中卤原子的种类 | |
| D. | 通常条件下,1mol的  分别与H2 和浓溴水完全反应时,消耗的H2和 分别与H2 和浓溴水完全反应时,消耗的H2和Br2的物质的量分别是 4mol、3mol |
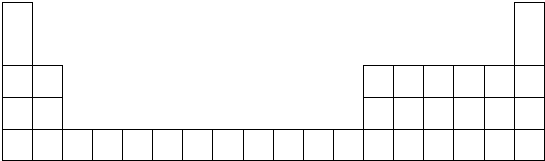
4.根据下表信息回答以下问题(均为短周期元素):
(1)在下表中用元素符号标出A、B、C、F的位置
(2)C、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Be(OH)2+2H+═Be2++2H2O.
(3)F在E中燃烧的化学反应方程式:4Li+O2点燃_2Li2O
(4)设计简单试管实验证明D元素与H元素的非金属性强弱关系:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
| 元素 | A | B | C | D | E | F | G | H |
| 原子半径(nm) | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 | 0.152 | 0.037 | 0.099 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1,-1 | +7,-1 |

(2)C、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Be(OH)2+2H+═Be2++2H2O.
(3)F在E中燃烧的化学反应方程式:4Li+O2点燃_2Li2O
(4)设计简单试管实验证明D元素与H元素的非金属性强弱关系:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
8.下列说法正确的是( )
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④中心原子采取sp3杂化的分子,其立体构型不一定是正四面体
⑤氢键不仅存在于分子之间,有时也存在于分子内
⑥3p2表示3p能级有两个轨道.
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④中心原子采取sp3杂化的分子,其立体构型不一定是正四面体
⑤氢键不仅存在于分子之间,有时也存在于分子内
⑥3p2表示3p能级有两个轨道.
| A. | ③④⑤ | B. | ①②③④⑤ | C. | ②③④ | D. | ②③④⑤⑥ |
9.若某基态原子的外围电子排布为3d34s2,则下列说法正确的是( )
| A. | 该元素基态原子中共有13个电子 | B. | 该元素原子核外有3个电子层 | ||
| C. | 该元素原子最外层共有5个电子 | D. | 该元素原子L能层共有8个电子 |
 某同学设计了如图的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图的实验装置来粗略地测定电石中碳化钙的质量分数.
 ;
; .
.