题目内容
5. 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.已知:C(s)+O2(g)?CO2(g)△H=-393kJ•mol-1;
2CO (g)+O2(g)?2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.8mol/(L•min).
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注.
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,
还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 $\frac{\underline{\;通电\;}}{\;}$2CO+O2,若阳
极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3.
分析 (1)水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2)即反应方程式为C(s)+H2O(g)=CO (g)+H2(g),再根据盖斯定律进行计算;
(2)①该反应前后气体体积不变,等比例增大反应物浓度,平衡不移动,实验1与实验2相比,实验2 温度高于实验1,浓度是实验1的$\frac{1}{2}$,平衡时n(CO2)是实验1的$\frac{1}{4}$,说明升温平衡逆向移动;
②v(H2)=v(CO2)=$\frac{\frac{△n}{V}}{△t}$;
③据转化率=$\frac{转化量}{加入量}$×100%计算;
④容器体积不变,起始量和平衡量相同,平衡没有移动,达平衡所用时间缩短,反应速率加快,只能是使用了催化剂;
(3)依据电解原理阳极上是氧气失电子发生氧化反应生成氢氧根离子;
(4)CO与银氨溶液反应将银氨溶液还原成黑色的银,本身在碱性溶液中被氧化成碳酸根.
解答 解:(1)已知:①C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1
②2CO (g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
将(①×2-②-③)×$\frac{1}{2}$得到反应C(s)+H2O(g)=CO (g)+H2(g),则△H═(-393kJ•mol-1×2+566kJ•mol-1+484kJ•mol-1)×$\frac{1}{2}$=+132 kJ•mol-1
故答案为:C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1;
(2)①该反应前后气体体积不变,等比例增大反应物浓度,平衡不移动,实验1与实验2相比,实验2 温度高于实验1,浓度是实验1 的$\frac{1}{2}$,平衡时n(CO2)是实验1的$\frac{1}{4}$,说明升温平衡逆向移动,正反应放热,故答案为:放热;
②v(H2)=v(CO2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{3.2mol}{1L}}{4min}$=0.8mol/(L•min),故答案为:0.8mol/(L•min);
③该反应反应物和生成物各物质化学计量数相同,所以生成0.8mol二氧化碳,则有0.8molCO反应,据转化率=$\frac{转化量}{加入量}$×100%=$\frac{0.8mol}{4mol}$×100%=20%,故答案为:20%;
④容器体积不变,起始量和平衡量相同,平衡没有移动,达平衡所用时间缩短,反应速率加快,只能是使用了催化剂,催化剂只加快反应速率,缩短达到平衡所用时间,不影响平衡移动,图象为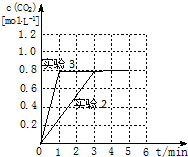 :故答案为:加催化剂;
:故答案为:加催化剂; ;
;
(3)以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2$\frac{\underline{\;电解\;}}{\;}$2CO+O2,则溶液中的氢氧根在阳极上失去电子发生氧化反应生成氧气,的电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(4)CO与银氨溶液反应将银氨溶液还原成黑色的银,本身在碱性溶液中被氧化成碳酸根,故反应的化学方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3,
故答案为:CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3.
点评 本题考查了盖斯定律的应用、据图表数据分析求算反应速率、转化率、平衡移动等等以及电化学中电极反应式书写、化学方程式书写,题目综合性强,难度大.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| A. | 将工厂的烟囱造高,可提高燃煤的燃烧效率,并可减少工厂周围的大气污染 | |
| B. | 垃圾焚烧法已成为许多城市垃圾处理的主要方法之一,利用垃圾焚烧产生的热能发电或供热,能较充分地利用生活垃圾中的生物质能 | |
| C. | 珍惜地球资源,发展低碳经济,积极开发使用风能、太阳能等新能源,可减少二氧化碳等气体的排放量 | |
| D. | 回收处理废旧电池既可节约金属资源又可减少环境污染,应积极开发废电池的综合利用技术 |
族 周期 | ||||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)②③④三种元素形成的离子中,离子半径由大到小的顺序是K+>Ca2+>Mg2+.
(3)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(4)元素⑦的氢化物的化学式为H2O;该氢化物常温下和②单质反应的化学方程式是2K+2H2O=2KOH+H2↑;若该氢化物和元素⑧的单质反应,则化学方程式为Cl2+H2O=HCl+HClO.
(5)⑨的最高价氧化物对应水化物的化学式为HBrO4;①和⑨两元素形成化合物为NaBr;该化合物灼烧时火焰颜色为黄色;该化合物的溶液与元素⑧的单质反应的离子方程式为2Br-+Cl2═2Cl-+Br2.
(6)①和⑤元素最高价氧化物对应水化物相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
| A. | pH=13的NaOH溶液中含有H+的浓度为0.l mol/L | |
| B. | 向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大 | |
| C. | 将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在: C(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| D. | Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)=c(HCO3-)>c(H+) |
| A. | NaCl是氯化钠晶体的分子式 | |
| B. | 氯化钠晶体中一个钠离子吸引一个氯离子 | |
| C. | NaCl晶体中不存在单个分子 | |
| D. | Na+和Cl-的基态最外层电子排布都是3s23p6 |

 .
. .
. .
.
 .
. ,则R有4种.
,则R有4种.