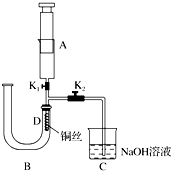
7.把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和后溶液显示弱酸性,则混合液中微粒浓度关系不正确的为( )
| A. | c(CH3COO-)>c(Na+) | B. | c(Na+)=c(CH3COO-)+c(CH3COOH) | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COOH)+c(CH3COO-)=0.01mol/L |
6.常温下,将0.2mol•L-1 CH3COOK 与0.1mol•L-1盐酸等体积混合后,溶液的pH<7,则溶液中下列微粒的物质的量浓度的关系正确的是( )
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
5.下列物质能促进水的电离,且溶液显酸性的是( )
| A. | NH4Cl | B. | NaF | C. | KOH | D. | H2SO4 |
4.下列水解的离子方程式正确的是( )
| A. | S2-+2H2O?H2S+2OH- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |
2.下列物质属于强电解质的是( )
| A. | CH3COOH | B. | BaSO4 | C. | NH3H2O | D. | SO3 |
19.根据如表五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
(1)在周期表中,最可能处于同一族的是E
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是D
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是C
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是p区元素,其氯化物的化学式为TCl3.
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是D
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是C
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是p区元素,其氯化物的化学式为TCl3.
18.如表为元素周期表中的一部分,列出11种元素在元素周期表中的位置.用化学符号回答下列各问题.
(1)11种元素中,第一电离能最小的是K;电负性最大的是F.(都用化学符号表示)
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,呈两性的是Al(OH)3.(填化学式)
(3)元素②的氢化物的电子式为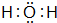 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
(4)④和⑦的最高价氧化物对应水化物的化学式分别为NaOH和HClO4.④和(11)两元素形成化合物的化学式为NaBr; 该化合物灼烧时的焰色为黄色
(5)第一电离能:⑤>⑥(填“>”“<”“=”),请说明原因:Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低.
0 168430 168438 168444 168448 168454 168456 168460 168466 168468 168474 168480 168484 168486 168490 168496 168498 168504 168508 168510 168514 168516 168520 168522 168524 168525 168526 168528 168529 168530 168532 168534 168538 168540 168544 168546 168550 168556 168558 168564 168568 168570 168574 168580 168586 168588 168594 168598 168600 168606 168610 168616 168624 203614
| 主族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | VII | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | (11) |
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,呈两性的是Al(OH)3.(填化学式)
(3)元素②的氢化物的电子式为
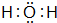 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑(4)④和⑦的最高价氧化物对应水化物的化学式分别为NaOH和HClO4.④和(11)两元素形成化合物的化学式为NaBr; 该化合物灼烧时的焰色为黄色
(5)第一电离能:⑤>⑥(填“>”“<”“=”),请说明原因:Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低.