题目内容
20.短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:(1)写出上述六种元素的元素符号:AOBFCMgDAlEPFS
(2)A、C所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了6个阴离子,晶体中阴阳离子数之比为1:1
(3)A、C所形成的化合物晶体的熔点比NaF晶体的熔点高,判断理由是离子半径相差不大,MgO中离子所带电荷较多,离子键强
(4)写出A、D形成的化合物与F最高价氧化物的水化物反应的离子方程式:Al2O3+6H+=2Al3++3H2O.
分析 原子序数依次增大的短周期元素A、B、C、D、E、F,A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O、B为F;C单质可与热水反应但不能与冷水反应,则C为Mg、D为Al;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P;F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S元素,综上所述:A为氧,B为氟,C为镁,D为铝,E为磷,F为硫,据此进行答题.
解答 解:原子序数依次增大的短周期元素A、B、C、D、E、F,A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O,B为F,C单质可与热水反应但不能与冷水反应,则C为Mg,D为Al,E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P,F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S,
(1)由上面的分析可知,A为O;B为F;C为Mg;D为Al;E为P;F为S,
故答案为:O;F;Mg;Al;P;S;
(2)A、C形成的化合物为MgO,根据NaCl晶体中每个Na+同时吸引着 6个Cl-,每个Cl-同时吸引着6个Na+,则氧化镁晶体中每个阳离子周围吸引了6个阴离子,晶体中阴阳离子数之比为1:1,
故答案为:6;1:1;
(3)A、C形成的化合物为MgO,由于MgO、NaF的离子半径相差不大,而MgO中离子所带电荷较多,离子键强,则氧化镁晶体的熔点大于NaF,
故答案为:高;离子半径相差不大,MgO中离子所带电荷较多,离子键强;
(4)A、D形成的化合物为氧化铝,F最高价氧化物的水化物硫酸,氧化铝与硫酸反应生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,推断各元素为解答关键,试题侧重考查学生的分析、理解能力,注意熟练掌握常见原子结构与元素周期律、元素周期表之间的关系.

| A. | S原子结构示意图: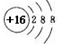 | |
| B. | 二氧化碳的电子式: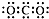 | |
| C. | H、D、T表示同一种核素 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}O$ |
| A. | NH4Cl | B. | NaF | C. | KOH | D. | H2SO4 |
| A. | 0.64g | B. | 1.28g | C. | 2.56g | D. | 5.12g |
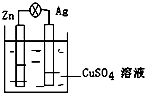 在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+,锌片上观察到的现象为Zn片逐渐溶解银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu,银片上观察到的现象是有红色物质析出.
在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+,锌片上观察到的现象为Zn片逐渐溶解银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu,银片上观察到的现象是有红色物质析出.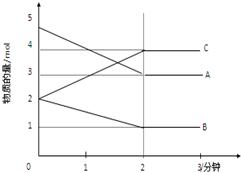 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体). .
.