题目内容
7.把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和后溶液显示弱酸性,则混合液中微粒浓度关系不正确的为( )| A. | c(CH3COO-)>c(Na+) | B. | c(Na+)=c(CH3COO-)+c(CH3COOH) | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COOH)+c(CH3COO-)=0.01mol/L |
分析 0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和后,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,混合溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,结合电荷守恒、物料守恒判断.
解答 解:0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和后,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,混合溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,
A.溶液呈酸性,则c(OH-)<c(H+),溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),则c(CH3COO-)>c(Na+),故A正确;
B.根据物料守恒得2c(Na+)=c(CH3COO-)+c(CH3COOH),故B错误;
C.溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,混合溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,所以c(CH3COOH)<c(CH3COO-),故C正确;
D.二者等体积混合后,醋酸溶液体积增大一倍,则c(CH3COOH)+c(CH3COO-)降为原来的一半,所以c(CH3COOH)+c(CH3COO-)=0.01mol/L,故D正确;
故选B.
点评 本题考查离子浓度大小比较,侧重考查学生分析判断能力,明确溶液中的溶质及其性质结合电解质溶液酸碱性判断,任何电解质溶液中都存在电荷守恒和物料守恒,易错选项是D.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
17.现已知O3分子为V字形结构,O3在水中的溶解度和O2比较要大或小( )
| A. | O3在水中的溶解度和O2一样 | B. | O3在水中的溶解度比O2小 | ||
| C. | O3在水中的溶解度比O2要大 | D. | 没办法比较 |
18.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2 SO2 | B. | C2H4 CH4 | C. | C60 C2H4 | D. | NH3 HCl |
2.下列物质属于强电解质的是( )
| A. | CH3COOH | B. | BaSO4 | C. | NH3H2O | D. | SO3 |
12.以惰性电极电解 CuSO4 溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为.( )
| A. | 0.64g | B. | 1.28g | C. | 2.56g | D. | 5.12g |
19.用惰性电极实现电解,下列说法正确的是( )
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液的pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小 | |
| C. | 电解氯化钾溶液,在阴极上和阳极上析出的产物的物质的量之比为1:1 | |
| D. | 电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2 |
16.水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14 mol2•L-2,K(35℃)=2.1×10-14 mol2•L-2.则下列叙述不正确的是( )
| A. | 纯水的pH随着温度的升高而降低 | B. | 在35℃时,[H+]>[OH-] | ||
| C. | 在25℃和35℃时,[H+]=[OH-] | D. | 水的电离是吸热的 |
 .
.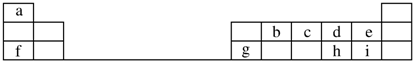
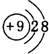 ,元素g的简单离子的结构示意图为
,元素g的简单离子的结构示意图为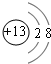 ,二者的离子半径大小顺序为F->Al3+.
,二者的离子半径大小顺序为F->Al3+.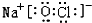 ,该化合物中所含的化学键类型为离子键、共价键.
,该化合物中所含的化学键类型为离子键、共价键.