题目内容
19.根据如表五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是D
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是C
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是p区元素,其氯化物的化学式为TCl3.
分析 由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,E的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,
(1)R和U的第一至第四电离能变化规律相似,即R和U最可能在同一主族;
(2)离子的氧化性最弱,即其对应的电离能最小;
(3)Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素;
(4)T元素表现+3价,氯化物的化学式为TCl3,最外层电子数为3,应为ns2np1,所以为p区元素.
解答 解:由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,则
(1)由上述分析可知,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,
故答案为:E;
(2)离子的氧化性最弱,即其对应的电离能最小,由表中数据看出U的第一电离能为420 kJ•mol-1,数值最小,故U+氧化性最弱,
故答案为:D;
(3)由表中数据可知,Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素,化学性质和物理性质最像氦,
故答案为:C;
(4)由上述分析可知,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,可能为P区元素,氯化物的化学式为TCl3,
故答案为:p,TCl3;
点评 本题考查电离能知识,题目难度中等,注意原子的最外层电子与电离能以及化合价的关系.

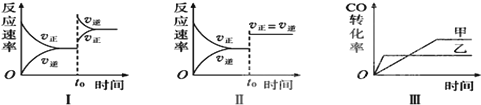
| A. | 图Ⅰ研究的是t0时升高温度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 | |
| C. | 图Ⅲ研究的是压强对化学平衡的影响,且乙压强大于甲 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
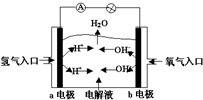
| A. | a电极是负极,电极反应为:H2-2e-═2H+ | |
| B. | b电极是正极,电极反应为:4OH-+4e-═2H2O+O2↑ | |
| C. | 电子从a极流向电流表、小灯泡、b极、通过电解质溶液形成闭合回路 | |
| D. | 电解质溶液中OH-向a极移动 |
| 选项 | 实验操作 | 现象 | 实验结论 |
| A | 向某工业废水中加入过量浓溴水 | 产生白色沉淀 | 该废水中可能含有苯酚 |
| B | 向溴乙烷中滴加硝酸银溶液 | 产生浅黄色沉淀 | 溴乙烷中含有溴元素 |
| C | 某有机物中加入金属Na | 产生气泡 | 该物质为乙醇 |
| D | 乙醇与浓硫酸共热,将产生的气体通入溴水中 | 溴水褪色 | 该气体一定为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
| A. | S2-+2H2O?H2S+2OH- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |
| A. | 升高温度和减小压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和增大压强 |
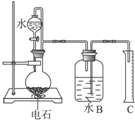 某同学设计了如图的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图的实验装置来粗略地测定电石中碳化钙的质量分数.