题目内容
3.某温度下,纯水中的c(H+)=3.0×10-7mol/L,则此时溶液中c(OH-)为3.0×10-7mol/L;若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则c(OH-)为1.8×10-8mol/L.分析 依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同;在酸溶液、碱溶液、盐溶液中存在离子积常数,Kw随温度变化;依据离子积计算离子浓度;
解答 解:某温度下纯水中的C(H+)=3.0×10-7mol/L,则此时溶液中的C(OH-)=3.0×10-7mol/L;若温度不变,滴入稀硫酸,使C(H+)=5.0×10-6mol/L,该温度下溶液中则溶液中C(H+)C(OH-)=9.0×10-14,C(OH-)=$\frac{9.0×1{0}^{-14}}{5.0×1{0}^{-6}}$=1.8×10-8mol/L,
故答案为:3.0×10-7mol/L;1.8×10-8mol/L;
点评 本题考查了水的离子积应用,溶液中离子积的计算判断,题目较简单.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
13.已知化合物NH5的结构和NH4Cl相似,下列关于NH5的下列说法中正确的是( )
| A. | NH5是共价化合物 | |
| B. | NH5的电子式为NH4+[:H]- | |
| C. | NH5中氢元素呈价+1和-1价 | |
| D. | NH5与水发生氧化还原反应,置换出氢气 |
11.下列关于原电池的说法正确的是( )
| A. | 把光能转变成了化学能 | B. | 把化学能转化成了光能 | ||
| C. | 把热能转变成了电能 | D. | 把化学能转化成了电能 |
18.如表为元素周期表中的一部分,列出11种元素在元素周期表中的位置.用化学符号回答下列各问题.
(1)11种元素中,第一电离能最小的是K;电负性最大的是F.(都用化学符号表示)
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,呈两性的是Al(OH)3.(填化学式)
(3)元素②的氢化物的电子式为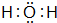 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
(4)④和⑦的最高价氧化物对应水化物的化学式分别为NaOH和HClO4.④和(11)两元素形成化合物的化学式为NaBr; 该化合物灼烧时的焰色为黄色
(5)第一电离能:⑤>⑥(填“>”“<”“=”),请说明原因:Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低.
| 主族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | VII | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | (11) |
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,呈两性的是Al(OH)3.(填化学式)
(3)元素②的氢化物的电子式为
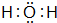 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑(4)④和⑦的最高价氧化物对应水化物的化学式分别为NaOH和HClO4.④和(11)两元素形成化合物的化学式为NaBr; 该化合物灼烧时的焰色为黄色
(5)第一电离能:⑤>⑥(填“>”“<”“=”),请说明原因:Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低.
8.下列事实中不能证明CH3COOH是弱电解质的是( )
| A. | 常温下某CH3COONa溶液的pH=8 | |
| B. | 用CH3COOH溶液做导电实验,灯泡很暗 | |
| C. | 等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多 | |
| D. | CH3COONa和H3PO4反应,生成CH3COOH. |
15.一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ,经测定完全吸收生成的二氧化碳需消耗5mol/L的KOH溶液200mL,恰好生成正盐.则此条件下反应:C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(g)的△H为( )
| A. | -16Q kJ/mol | B. | +8Q kJ/mol | C. | +16 Q kJ/mol | D. | -8 Q kJ/mol |
 ③
③
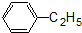 ⑤
⑤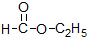 ⑥
⑥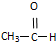
 B.
B. C.甲醇 D.CH3-O-CH3E.HO-CH2CH2-OH
C.甲醇 D.CH3-O-CH3E.HO-CH2CH2-OH