题目内容
4.下列水解的离子方程式正确的是( )| A. | S2-+2H2O?H2S+2OH- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |
分析 A.硫离子的水解分步进行,主要以第一步为主;
B.醋酸根离子水解生成醋酸和氢氧根离子;
C.该反应为醋酸的电离方程式,不是水解方程式;
D.铁离子水解生成氢氧化铁胶体,不能使用沉淀符号.
解答 解:A.硫离子的水解分步进行,正确的水解方程式为:S2-+H2O?HS-+OH-,故A错误;
B.醋酸为弱酸,醋酸根离子在溶液中部分水解生成醋酸和氢氧根离子,水解的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,故B正确;
C.CH3COOH+H2O?CH3COO-+H3O+为醋酸的电离方程式,故C错误;
D.铁离子的水解程度较小,不能使用沉淀符号,正确的水解离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故D错误;
故选B.
点评 本题考查了离子方程式的书写、水解原理及其应用,题目难度中等,明确水解原理与弱电解质的电离为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.在反应容器中充人SO2 V1L和H2S V2L(标准状况下),充分作用后测知所得氧化产物比还原产物多1.6克,则以下推断一定错误的是( )
| A. | V1>1.12 V2>2.24 | B. | Vl+V2≥3.36 | ||
| C. | 若Vl=1.12,则V2≥2.24 | D. | 若V1≥1.12,则V2=2.24 |
12.下列有关叙述正确的是( )
| A. | 氢键是一种特殊化学键,它广泛地存在于自然界中 | |
| B. | 在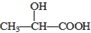 分子中含有1个手性C原子 分子中含有1个手性C原子 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越强 |
19.根据如表五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
(1)在周期表中,最可能处于同一族的是E
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是D
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是C
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是p区元素,其氯化物的化学式为TCl3.
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是D
A.S2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是C
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是p区元素,其氯化物的化学式为TCl3.
9.下列的比较关系不正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | 相等浓度的CH3COONa、NaOH和NaHCO3三种溶液的pH:pH(CH3COONa)>pH (NaHCO3)>pH(NaOH) | |
| C. | 0.1mol•L-1的NaHA溶液,其pH=4:c(Na+)>c(HA-)>c(H+)>c(A2-)>c (H2A) | |
| D. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液成酸性:c(CH3COO-)>c(CH3COOH) |
16.将分别盛有熔融NaCl、MgCl2、Al2O3(熔有冰晶石)的三个电解槽,在一定条件下通电一段时间后,析出Na、Mg、Al的物质的量之比是( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |

 ;
;