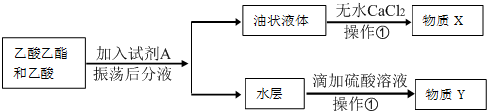
14.如图是某条件时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )


| A. | 升高温度可增大正反应速率,降低逆反应速率 | |
| B. | 正反应的活化能大于逆反应的活化能 | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ•mol-1 |
12.下列离子方程式与所述事实相符且正确的是( )
| A. | 铝和氢氧化钠溶液反应:2Al+2OH-=2AlO2-+H2↑ | |
| B. | 铜与足量FeCl3溶液反应:Fe3++Cu=Fe2++Cu2+ | |
| C. | 用醋酸除去水瓶中的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 向苯酚钠溶液中通入CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- |
11.在含有大量的Na+、OH-、NO3-,该溶液中还可能大量存在的离子是( )
| A. | NH4+ | B. | HCO3- | C. | SO42- | D. | Mg2+ |
10.煤和石油与生活密切相关,下列有关煤和石油的综合利用中,属于物理变化的是( )
| A. | 煤的干馏 | B. | 煤的气化和液化 | ||
| C. | 石油的分馏 | D. | 石油的裂化和裂解 |
8.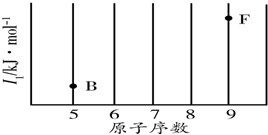 研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.
研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.
(1)C、Si、N元素的电负性由大到小的顺序是N>C>Si.
(2)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式:1s22s22p63s2.
(3)依据第2周期元素第一电离能的变化规律,参照图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
(4)基态铜原子的核外电子排布式为1s22s22p63s23p63d104s1.
(5)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
 研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.
研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.(1)C、Si、N元素的电负性由大到小的顺序是N>C>Si.
(2)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)基态铜原子的核外电子排布式为1s22s22p63s23p63d104s1.
(5)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
6.现有下列短周期元素性质的数据:
试回答下列问题:
(1)元素③在周期表中的位置是第二周期第ⅠA族;元素①②④⑦的气态氢化物中最稳定的是H2O(填化学式);
(2)上述元素形成的单核离子中半径最大的是P3-,半径最小的是Li+;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式4Cl2+H2S+4H2O═10H++8Cl-+SO42-.
0 168383 168391 168397 168401 168407 168409 168413 168419 168421 168427 168433 168437 168439 168443 168449 168451 168457 168461 168463 168467 168469 168473 168475 168477 168478 168479 168481 168482 168483 168485 168487 168491 168493 168497 168499 168503 168509 168511 168517 168521 168523 168527 168533 168539 168541 168547 168551 168553 168559 168563 168569 168577 203614
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)元素③在周期表中的位置是第二周期第ⅠA族;元素①②④⑦的气态氢化物中最稳定的是H2O(填化学式);
(2)上述元素形成的单核离子中半径最大的是P3-,半径最小的是Li+;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式4Cl2+H2S+4H2O═10H++8Cl-+SO42-.
 乙
乙 丙
丙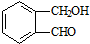


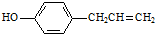 )
)