题目内容
9.推断下列化合物的化学式:(1)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是CaF2;若XY2是共价化合物,其化学式是BeCl2、CS2.
(2)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为MgS.
(3)1mol某共价化合物,含有三种短周期元素的原子各1mol,且三种元素分别属于不同的周期,其质子总数为26mol,其中一种元素的最外层有7个电子,则该物质的化学式为HClO.
(4)某非金属X的最低负价为-2,它的最高价氧化物对应的水化物为强酸,则这种酸的化学式是H2SO4.
(5)X元素的最高正价和负价绝对值之差为6,Y元素的化合价为+1,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是KCl.
分析 (1)XY2型化合物,可能为第ⅡA族与ⅤⅡ族元素形成,也可能为第ⅣA族与ⅥA族元素形成;
(2)XY型化合物,原子序数之差为4,则为第ⅡA族与第ⅥA族元素形成;
(3)1mol某物质含有不同周期三种元素的原子各1mol,则一定含有H,其中一种元素的最外层有7个电子,处于ⅦA族,质子总数为26mol,另外元素应分别为Cl、O,该物质为次氯酸;
(4)某非金属X的最低负价为-2,处于ⅥA族,它的最高价氧化物对应的水化物为强酸,X为硫元素;
(5)X元素的最高正价和负价绝对值之差为6,处于ⅦA族,Y元素的化合价为+1,处于IA族,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则X为Cl,Y为K.
解答 解:(1)XY2型化合物,可能为第ⅡA族与ⅤⅡ族元素形成,也可能为第ⅣA族与ⅥA族元素形成,XY2中共有38个电子,若XY2是离子化合物,则为CaF2;若为共价化合物,则为BeCl2、CS2,
故答案为:CaF2;BeCl2、CS2;
(2)XY型化合物,原子序数之差为4,则为第ⅡA族与第ⅥA族元素形成,应为第三周期的Mg、S,该化合物为MgS,故答案为:MgS;
(3)1mol某物质含有不同周期三种元素的原子各1mol,则一定含有H,其中一种元素的最外层有7个电子,处于ⅦA族,质子总数为26mol,另外元素应分别为Cl、O,该物质为次氯酸,化学式为HClO,故答案为:HClO;
(4)某非金属X的最低负价为-2,处于ⅥA族,它的最高价氧化物对应的水化物为强酸,X为硫元素,该酸为:H2SO4,故答案为:H2SO4;
(5)X元素的最高正价和负价绝对值之差为6,处于ⅦA族,Y元素的化合价为+1,处于IA族,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则X为Cl,Y为K,该化合物为KCl,故答案为:KCl.
点评 本题考查元素化合物的推断,涉及知识点较多,是对学生综合能力的考查,需要学生具备扎实的基础,熟练掌握常见元素化合物结构及性质,题目难度中等.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | [Co(NH3)3Cl3] | B. | [Co(NH3)6]Cl3 | C. | [Co(NH3)4Cl2]Cl | D. | [Co(NH3)5Cl]Cl2 |

| A. | 元素的简单离子半径M<W<Z | |
| B. | Y元素在自然界存在多种同素异形体 | |
| C. | 最高价氧化物的水化物酸性W>N | |
| D. | N与Z的质子数之差为16 |
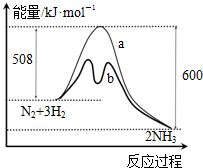
| A. | 升高温度可增大正反应速率,降低逆反应速率 | |
| B. | 正反应的活化能大于逆反应的活化能 | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ•mol-1 |

| A. | 阳极的电极反应式为2SO42--2e-═S2O82- | |
| B. | 电解的总反应方程式为2KHSO4$\frac{\underline{\;通电\;}}{\;}$K2S2O8+H2↑ | |
| C. | 一段时间后,溶液的pH减小 | |
| D. | 电解过程中,阳极产生微量能使湿润的淀粉KI试纸变蓝的有色单质气体,该气体可能是O3 |
| A. | 离子键 | B. | π键 | C. | 配位键 | D. | 氢键 |
| A. | H2SO4 | B. | MgCl2 | C. | N2 | D. | NH4Cl |
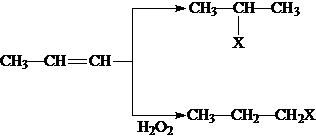 (X为溴原子)
(X为溴原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.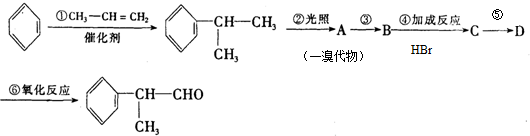
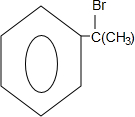
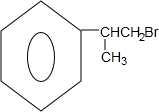 .
. 、
、 、
、 任意1种.
任意1种.