题目内容
7.五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
(1)五种元素中,原子半径最大的是Na,非金属性最强的是Cl.(填元素符号)
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是PH3(用化学式表示).
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为NH4Cl,其中存在的化学键类型为离子键和共价键.
(4)D最高价氧化物的水化物的化学式为H3PO4.
(5)单质E与水反应的离子方程式为Cl2+H2O═H++Cl-+HClO.
分析 五种短周期元素A、B、C、D、E的原子序数依次增大,A和B、D、E均能形成共价型化合物,A和B形成的化合物在水中呈碱性,该化合物为氨气,则A是H、B是N元素;
A和C同族,且C原子序数大于B,C离子和B离子具有相同的电子层结构,则C是Na元素;
B和D同族,则D是P元素;
C和E形成的化合物在水中呈中性,则E是Cl元素,
(1)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素,元素非金属性随着原子序数增大而减弱;
(2)元素的非金属性越强,其氢化物的稳定性越强;
(3)A和E形成的化合物是HCl,A和B形成的化合物是氨气,氯化氢和氨气反应生成氯化铵,铵盐中存在离子键和共价键;
(4)D最高价氧化物的水化物是磷酸;
(5)单质E是氯气,氯气和水反应生成HCl和HClO,次氯酸是弱酸.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大,A和B、D、E均能形成共价型化合物,A和B形成的化合物在水中呈碱性,该化合物为氨气,则A是H、B是N元素;
A和C同族,且C原子序数大于B,C离子和B离子具有相同的电子层结构,则C是Na元素;
B和D同族,则D是P元素;
C和E形成的化合物在水中呈中性,则E是Cl元素,
(1)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径最大的元素位于周期表左下角,这几种元素中原子半径最大的是Na元素;
同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素,元素非金属性随着原子序数增大而减弱,这几种元素中非金属性最强的是Cl元素;
故答案为:Na;Cl;
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>N>P,所以氢化物的稳定性最差的是PH3,故答案为:PH3;
(3)A和E形成的化合物是HCl,A和B形成的化合物是氨气,氯化氢和氨气反应生成氯化铵,化学式为NH4Cl,铵盐中存在离子键和共价键,所以氯化铵中含有离子键和共价键,故答案为:NH4Cl;离子键和共价键;
(4)D最高价氧化物的水化物是磷酸,化学式为H3PO4,故答案为:H3PO4;
(5)单质E是氯气,氯气和水反应生成HCl和HClO,次氯酸是弱酸,离子方程式为Cl2+H2O═H++Cl-+HClO,故答案为:Cl2+H2O═H++Cl-+HClO.
点评 本题考查位置结构性质相互关系及应用,侧重考查学生推断及知识运用能力,涉及氧化还原反应、元素周期律、化学键等知识点,正确判断元素是解本题关键,注意铵盐中存在的化学键,题目难度不大.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案 中,同一平面上碳原子最多数目和同一直线上的碳原子最多数目分别为( )
中,同一平面上碳原子最多数目和同一直线上的碳原子最多数目分别为( )| A. | 11、4 | B. | 10、3 | C. | 12、4 | D. | 13、4 |
| A. | 铝与NaOH溶液反应:Al+6OH-═[Al(OH)4]-+H2↑ | |
| B. | 向AlCl3溶液中滴入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| C. | Al2O3与NaOH溶液反应:Al2O3+2OH-+3H2O═2[Al(OH)4]- | |
| D. | Ba(OH)2溶液与明矾溶液反应至Al3+完全沉淀:Ba2++3OH-+Al3++SO42-═Al(OH)3↓+BaSO4↓ |
| A. | 铝和氢氧化钠溶液反应:2Al+2OH-=2AlO2-+H2↑ | |
| B. | 铜与足量FeCl3溶液反应:Fe3++Cu=Fe2++Cu2+ | |
| C. | 用醋酸除去水瓶中的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 向苯酚钠溶液中通入CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- |
 常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )| A. | MOH为强碱 | |
| B. | 该混合液pH=7 | |
| C. | 该混合溶液中:c(Cl-)=c(M+) | |
| D. | 图中X表示M+,Y表示H+,Y表示MOH,R表示OH- |
| A. | 标准状况下,22.4L CCl4中含有共用电子对数目为4.0NA | |
| B. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.2NA | |
| C. | 1 mol CO2与1 mol Na2O2完全反应时,转移的电子数目为NA | |
| D. | 9.2 g NO2气体中含有分子数目为0.2NA |

 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$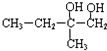 +2NaBr,反应类型是取代反应.
+2NaBr,反应类型是取代反应.