题目内容
11.在含有大量的Na+、OH-、NO3-,该溶液中还可能大量存在的离子是( )| A. | NH4+ | B. | HCO3- | C. | SO42- | D. | Mg2+ |
分析 能够发生反应的离子之间在溶液中不能大量共存,如:铵根离子、碳酸氢根离子、镁离子能够与氢氧根离子反应,在溶液中不能大量共存,而硫酸根离子都不与Na+、OH-、NO3-反应,在溶液中可大量共存.
解答 解:NH4+、HCO3-、Mg2+离子都与OH-反应,在溶液中不能大量共存,故A、B、D错误;
Na+、OH-、NO3-都不与SO42-反应,在溶液中能够大量共存,故C正确;
故选C.
点评 本题考查了离子共存的欧弟,题目难度中等,明确离子共存的条件是解本题关键,根据离子共存的条件来分析解答即可,离子共存是高考热点,此类题还要考虑限制性条件、隐含条件,为易错点.

练习册系列答案
相关题目
2.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | CO2的电子式 | B. | Cl-的结构示意图: | ||
| C. | 乙烯的结构简式C2H4 | D. | Z质量数为37的氯原子${\;}_{37}^{17}$Cl |
6.现有下列短周期元素性质的数据:
试回答下列问题:
(1)元素③在周期表中的位置是第二周期第ⅠA族;元素①②④⑦的气态氢化物中最稳定的是H2O(填化学式);
(2)上述元素形成的单核离子中半径最大的是P3-,半径最小的是Li+;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式4Cl2+H2S+4H2O═10H++8Cl-+SO42-.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)元素③在周期表中的位置是第二周期第ⅠA族;元素①②④⑦的气态氢化物中最稳定的是H2O(填化学式);
(2)上述元素形成的单核离子中半径最大的是P3-,半径最小的是Li+;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式4Cl2+H2S+4H2O═10H++8Cl-+SO42-.
16.下面是某研究小组研究的关于不同催化剂对H2O2 分解反应的催化效率.
(1)写出H2O2 在催化剂作用下分解反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是MnO2(粉末状)>FeCl3>KI>活性炭,等质量的固体催化剂,颗粒大小对催化效率有什么影响颗粒越小催化效果越好.
(3)实验发现新鲜的动物肝脏对H2O2 的分解也有显著的催化作用,但当往溶液中加入盐酸,或给溶液加热时,就会失去催化能力,合理的解释是催化剂失去活性.
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml)[来 | 5 | 11 | 7 | 8[ | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是MnO2(粉末状)>FeCl3>KI>活性炭,等质量的固体催化剂,颗粒大小对催化效率有什么影响颗粒越小催化效果越好.
(3)实验发现新鲜的动物肝脏对H2O2 的分解也有显著的催化作用,但当往溶液中加入盐酸,或给溶液加热时,就会失去催化能力,合理的解释是催化剂失去活性.
3. 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
(1)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+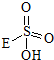 →
→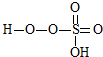 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.
(4)F位于d区,价电子排布式为3d54s1.
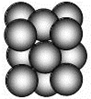
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}}{6}π$.
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+
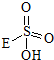 →
→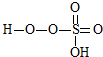 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.(4)F位于d区,价电子排布式为3d54s1.
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}}{6}π$.
 已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应.甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体.请回答下列问题.
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应.甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体.请回答下列问题.
 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则