19.福岛核电站泄漏的放射性物质中含有${\;}_{53}^{131}$I,下列有关${\;}_{53}^{131}$I的说法正确的是( )
| A. | 由此可确定碘元素的相对原子质量为131 | |
| B. | ${\;}_{53}^{131}$I是碘元素的一种核素 | |
| C. | ${\;}_{53}^{131}$I核素中含中子数为53 | |
| D. | ${\;}_{53}^{131}$I2的摩尔质量为262g |
18.现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗.有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液.试回答以下问题.
(1)做酸碱中和滴定时,还缺少的试剂是蒸馏水和指示剂
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间.褪色所需时间tA<tB(填“>”、“=”或“<”).写出该反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol•L-1KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液紫红色并没有马上退去.将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪色了,可能原因是反应中生成的Mn2+有催化作用;当滴入最后一滴溶液,由无色变为浅紫色,且半分钟内不褪色,说明达到滴定终点.
③计算:重复上述操作2次,记录实验数据如下表.则消耗KMnO4溶液的平均体积为20.00mL,此样品的纯度为90.00%.(已知H2C2O4的相对分子质量为90)
④误差分析:下列操作会导致测定结果偏高的是AC.
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视.
(1)做酸碱中和滴定时,还缺少的试剂是蒸馏水和指示剂
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间.褪色所需时间tA<tB(填“>”、“=”或“<”).写出该反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol•L-1KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液紫红色并没有马上退去.将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪色了,可能原因是反应中生成的Mn2+有催化作用;当滴入最后一滴溶液,由无色变为浅紫色,且半分钟内不褪色,说明达到滴定终点.
③计算:重复上述操作2次,记录实验数据如下表.则消耗KMnO4溶液的平均体积为20.00mL,此样品的纯度为90.00%.(已知H2C2O4的相对分子质量为90)
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视.
17.如图曲线a和b是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是( )

| A. | NaOH溶液的浓度为0.1 mol•L-1 | |
| B. | P点时恰好完全反应,溶液呈中性 | |
| C. | 曲线a是盐酸滴定氢氧化钠溶液的测定曲线 | |
| D. | 本实验的指示剂不能用甲基橙,只能用酚酞 |
16.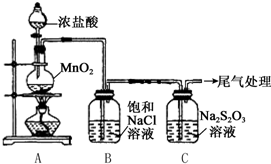 某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
实验操作和现象:
查阅资料:a.S2O32-有较强的还原性
b.酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)为检验C中是否有SO2生成,需进行的操作是把白雾通入Ba(NO3)2溶液中,若有白色沉淀,证明有SO2生成.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是S2O32-+4Cl2+5H2O=8Cl-+2SO42-+10H+.
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.
 某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).实验操作和现象:
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
b.酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)为检验C中是否有SO2生成,需进行的操作是把白雾通入Ba(NO3)2溶液中,若有白色沉淀,证明有SO2生成.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是S2O32-+4Cl2+5H2O=8Cl-+2SO42-+10H+.
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.
15.羟基扁桃酸可由苯酚和乙醛酸通过一步反应制得,下列有关说法正确的是( )


| A. | 羟基扁桃酸可以发生加成反应 | |
| B. | 上述反应属于取代反应 | |
| C. | 乙醛酸的核磁共振氢谱中有2个吸收峰 | |
| D. | 羟基扁桃酸能发生消去反应 |
14.下列各组有机物,只用溴水就能鉴别的是( )
| A. | 己烯 苯 四氯化碳 | B. | 苯 己烯 己炔 | ||
| C. | 苯 己烷 己炔 | D. | 溴己烷 苯 己烯 |
13.使用氢氧燃料电池的公共汽车已在北京街头出现.某种以30%KOH溶液为电解质的氢氧燃料电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O O2+2H2O+4e-═4OH-.下列有关该氢氧燃料电池的说法中,正确的是( )
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中H2和O2燃烧放出的热量转变为电能 | |
| D. | 氢氧燃料电池产物是水,属于环境友好电池 |
12.有机物种类繁多的主要原因是( )
| A. | 有机物都是天然产物 | |
| B. | 自然界中存在着多种形式的、大量的有机物 | |
| C. | 有机物除含碳元素外,还含有其他多种元素 | |
| D. | 碳原子能与其他原子形成四个共价键,且碳原子之间也能相互成键 |
11.近来,科学家研制了一种新型的乙醇电池,它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O2→2CO2+3H2O.下列说法不正确的是( )
| A. | C2H5OH在电池的负极上参加反应 | |
| B. | 在外电路中电子由负极沿导线流向正极 | |
| C. | 1mol乙醇被氧化转移6mol电子 | |
| D. | 电解质溶液中阳离子移向正极,阴离子移向负极 |
10.R、W、X、Y、Z是同一短周期主族元素,原子序数依次递增.下列说法一定正确的是(m,n均为整数)( )
0 168319 168327 168333 168337 168343 168345 168349 168355 168357 168363 168369 168373 168375 168379 168385 168387 168393 168397 168399 168403 168405 168409 168411 168413 168414 168415 168417 168418 168419 168421 168423 168427 168429 168433 168435 168439 168445 168447 168453 168457 168459 168463 168469 168475 168477 168483 168487 168489 168495 168499 168505 168513 203614
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若Y的最低负化合价为-2,则Z的最高正化合价为+6 | |
| C. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| D. | 若X的最高正化合价为+5,则五种元素一定都是非金属元素 |