题目内容
15.羟基扁桃酸可由苯酚和乙醛酸通过一步反应制得,下列有关说法正确的是( )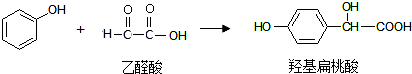
| A. | 羟基扁桃酸可以发生加成反应 | |
| B. | 上述反应属于取代反应 | |
| C. | 乙醛酸的核磁共振氢谱中有2个吸收峰 | |
| D. | 羟基扁桃酸能发生消去反应 |
分析 A.羟基扁桃酸含有苯环,可发生加成反应;
B.反应中C=O变成C-O键,以此判断;
C.乙醛酸结构不对称,含有2种H原子;
D.羟基邻位碳元素不含有氢原子.
解答 解:A.羟基扁桃酸含有苯环,可发生加成反应,在一定条件下可与氢气发生加成反应,故A正确;
B.两种有机物生成一种有机物,反应C=O变成C-O单键,为加成反应,故B错误;
C.乙醛酸结构不对称,含有2种H原子,则核磁共振氢谱中有2个吸收峰,故C正确;
D.羟基邻位碳元素不含有氢原子,不能发生消去反应,故D错误.
故选AC.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,本题注意把握有机物的结构和官能团的性质,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
6.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为互为同位素;R在元素周期表中的位置是第3周期ⅦA族.
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是b、c(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm-0.144nm;写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
| X | Y | Z | M | R | Q | |
| 原子半 径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要 化合价 | -4, +4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是b、c(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm-0.144nm;写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
10.R、W、X、Y、Z是同一短周期主族元素,原子序数依次递增.下列说法一定正确的是(m,n均为整数)( )
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若Y的最低负化合价为-2,则Z的最高正化合价为+6 | |
| C. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| D. | 若X的最高正化合价为+5,则五种元素一定都是非金属元素 |
20.据报道,碳纳米管是碳原子形成的大分子,其导电性是铜1万倍;N5可以做烈性炸药.下列叙述正确的是( )
| A. | 14C的质子数为14 | B. | N5N2互为同素异形体 | ||
| C. | 金刚石和纳米管互为同位素 | D. | C原子半径比N原子半径小 |
7.设NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 1mol氯气参加氧化还原反应,转移的电子数一定为2 NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,44g二氧化碳分子中所形成的共用电子对数为4NA | |
| D. | 常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA |
5.下列电子式,正确的是( )
| A. | 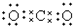 | B. | K+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | ||
| C. | 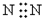 | D. |  |
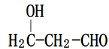 .
.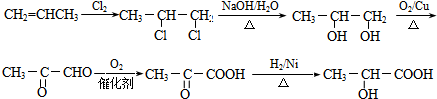 .
.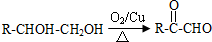
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题: