题目内容
10.R、W、X、Y、Z是同一短周期主族元素,原子序数依次递增.下列说法一定正确的是(m,n均为整数)( )| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若Y的最低负化合价为-2,则Z的最高正化合价为+6 | |
| C. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| D. | 若X的最高正化合价为+5,则五种元素一定都是非金属元素 |
分析 同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,结合元素在周期表中的相对位置结合元素对应的单质、化合物的性质解答该题.
解答 解:A.同周期元素从左到右元素的金属性逐渐减弱,若R(OH)n为强碱,则W(OH)m不一定为强碱,故A错误;
B.若Y的最低化合价为-2,则Z的最低价为-1价,其最高正化合价为+7,故B错误;
C.同周期元素从左到右元素的非金属性逐渐增强,若HnXOm为强酸,如X为N元素,则Y可能为O,为活泼非金属元素,故C正确;
D.X的最高正化合价为+5,若X为P,则R一定为金属元素,故D错误.
故选C.
点评 本题考查同周期元素的性质的递变规律,为高频考点,本题注意把握同周期元素的性质的递变规律和在元素周期表中的可能位置,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
1.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(用推断出的元素符号回答问题)
(1)Z位于元素周期表第三周期第ⅦA族,Y的氢化物电子式是 .
.
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S,对应氢化物较稳定的是HCl.
(3)写出X的单质与Y的最高价氧化物对应水化物的浓溶液反应的方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(4)写出W元素的原子核外价电子排布式3d104s1.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(1)Z位于元素周期表第三周期第ⅦA族,Y的氢化物电子式是
 .
.(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S,对应氢化物较稳定的是HCl.
(3)写出X的单质与Y的最高价氧化物对应水化物的浓溶液反应的方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(4)写出W元素的原子核外价电子排布式3d104s1.
18.去乙酸乙酯中含有的乙酸,最好的处理操作是( )
| A. | 蒸馏 | B. | 用过量氢氧化钠溶液洗涤后分液 | ||
| C. | 水洗后分液 | D. | 用过量饱和碳酸钠溶液洗涤后分液 |
5.下列叙述正确的是( )
| A. | L层电子数为奇数的所有元素都是非金属 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第3、4、5、6周期元素的数目分别是8、18、32、32 | |
| D. | 元素周期表中第8、9、12列没有非金属 |
15.羟基扁桃酸可由苯酚和乙醛酸通过一步反应制得,下列有关说法正确的是( )
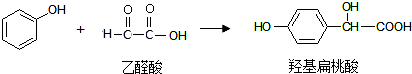

| A. | 羟基扁桃酸可以发生加成反应 | |
| B. | 上述反应属于取代反应 | |
| C. | 乙醛酸的核磁共振氢谱中有2个吸收峰 | |
| D. | 羟基扁桃酸能发生消去反应 |
2.关于下式表示的有机物的性质叙述中不正确的是( )


| A. | 它有酸性,能与纯碱溶液反应 | |
| B. | 它可以水解,水解产物只有一种 | |
| C. | 1 mol该有机物最多能和7 mol NaOH反应 | |
| D. | 该有机物能发生取代反应 |
19.下列过程中,离子键被破坏的是( )
| A. | 干冰升华 | B. | KNO3熔化 | C. | NaCl溶于水 | D. | HCl气体溶于水 |
