20.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是研究温度对H2O2分解速率的影响,实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
(2)实验①的目的是研究温度对H2O2分解速率的影响,实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
15.下列排列顺序正确的是( )
| A. | 半径:Al3+>Mg2+>Na+>F- | B. | 稳定性:HI<HBr<HCl<HF | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 碱性:Al(OH)3>Mg(OH)2>Ca(OH)2 |
14.下列微粒中半径最小的( )
| A. | Na+ | B. | Al3+ | C. | K+ | D. | S2- |
11.下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明固体反应物的表面积对反应速率有影响.
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填实验序号).
(3)其实验6和其实验7表明温度对反应速率有影响.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:可能是硫酸过量,等质量的金属完全反应,放出的热量相等,所以使等体积溶液的温度升高值相近.
0 168288 168296 168302 168306 168312 168314 168318 168324 168326 168332 168338 168342 168344 168348 168354 168356 168362 168366 168368 168372 168374 168378 168380 168382 168383 168384 168386 168387 168388 168390 168392 168396 168398 168402 168404 168408 168414 168416 168422 168426 168428 168432 168438 168444 168446 168452 168456 168458 168464 168468 168474 168482 203614
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4)/mol•L-1 | v(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)实验4和5表明固体反应物的表面积对反应速率有影响.
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填实验序号).
(3)其实验6和其实验7表明温度对反应速率有影响.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:可能是硫酸过量,等质量的金属完全反应,放出的热量相等,所以使等体积溶液的温度升高值相近.
 短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题
短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题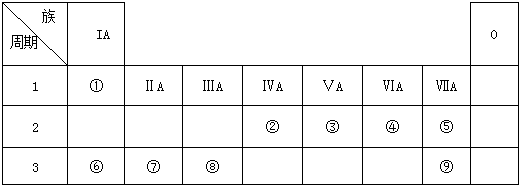
 .
.
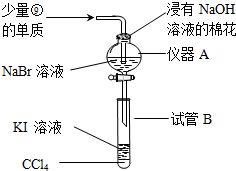
 元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是
元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是 .
.
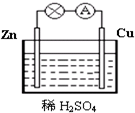 图为原电池的示意图.请回答:
图为原电池的示意图.请回答:
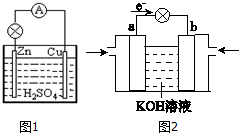 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.