题目内容
17.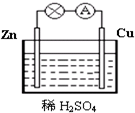 图为原电池的示意图.请回答:
图为原电池的示意图.请回答:(1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).
(2)电子(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中的H+在
铜片(填“锌片”或“铜片”)上获得电子.
(3)原电池工作一段时间后,H2SO4溶液的浓度减小(填“增大”或“减小”)
(4)如Zn棒质量减轻3.25g,则另一极放出气体的体积为1.12L(标准状况).
分析 (1)锌铜原电池依据装置图分析,锌做负极失电子发生氧化反应生成锌离子;
(2)铜做正极,溶液中氢离子得到电子生成氢气,发生还原反应,电子流向从负极沿导线流向正极,溶液中阳离子移向正极;
(3)原电池工作时,因正极发生2H++2e-=H2↑;
(4)如Zn棒质量减轻3.25g,n(Zn)=$\frac{3.25g}{65g/mol}$=0.05mol,由Zn-2e-=Zn2+可知,转移2mol电子,则由2H++2e-=H2↑可知,生成1mol氢气,体积为22.4 L.
解答 解:(1)锌铜原电池依据装置图分析,锌做负极失电子发生氧化反应生成锌离子,负极发生的反应是Zn-2e-=Zn2+,
故答案为:负;Zn-2e-=Zn2+;氧化反应;
(2)铜做正极,溶液中氢离子得到电子生成氢气,发生还原反应,电子流向从负极沿导线流向正极,溶液中阳离子移向正极;
故答案为:电子;铜片;
(3)原电池工作时,因正极发生2H++2e-=H2↑,则硫酸浓度减小,故答案为:减小;
(4)如Zn棒质量减轻3.25g,n(Zn)=$\frac{3.25g}{65g/mol}$=0.05mol,由Zn-2e-=Zn2+可知,转移2mol电子,则由2H++2e-=H2↑可知,生成1mol氢气,体积为22.4 L,所以转移电子的物质的量为0.05×2=0.1mol,生成气体体积为:1.12L;
故答案为:1.12L.
点评 本题考查了原电池原理的分析应用主要是电极反应,电极判断,电子流向,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
8.在密闭容器中发生反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为0.2mol•L-1、0.3mol•L-1和0.2mol•L-1,则平衡时各物质的浓度不可能是( )
| A. | X为0.25 mol•L-1 | |
| B. | Y为0.1 mol•L-1 | |
| C. | Z为0.2 mol•L-1 | |
| D. | Z为0.25 mol•L-1时,Y为0.45 mol•L-1 |
5.苯与乙烯、乙炔相比较,下列叙述不正确的是( )
| A. | 同质量的乙炔和苯完全燃烧生成二氧化碳的质量完全相等 | |
| B. | 都容易发生取代反应 | |
| C. | 苯只能在特殊条件下发生加成反应 | |
| D. | 苯不能被KmnO4所氧化 |
9.下列有关钠的叙述中,错误的是( )
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 钠极易和水反应而被还原 | |
| D. | 钠、氧化钠、氢氧化钠的焰色反应均显黄色 |
6.决定粒子是否为同一种元素的是( )
| A. | 粒子内所具有的质子数 | B. | 原子核内的质子数 | ||
| C. | 原子或单核离子的质量数 | D. | 原子核外的电子数 |
7.下列推断正确的是( )
| A. | 分子晶体中一定存在范德华力和共价键两种作用力,可能存在氢键 | |
| B. | 某晶体熔融态能导电,则一定是离子晶体 | |
| C. | 分子晶体、原子晶体、离子晶体、金属晶体都可以采用紧密堆积方式 | |
| D. | 金属元素形成的化合物可能是分子晶体 |
 .
.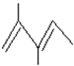 .
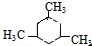
.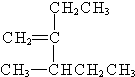 3-甲基-2-乙基-1-戊烯;
3-甲基-2-乙基-1-戊烯; 2,2,6-三甲基-4-乙基辛烷.
2,2,6-三甲基-4-乙基辛烷.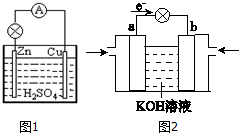 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置. 、
、