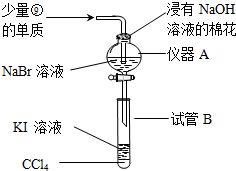
题目内容
13.Cu与一定浓度的硝酸反应时,其方程式可表示为:Cu+HNO3--Cu(NO3)2+NO↑+NO2↑+H2O(1)硝酸在反应中的性质是氧化性、酸性.
(2)0.3molCu被完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是0.9mol,若用排水法收集这些气体,可得到标准状况下的体积4.48 L.
(3)如果参加反应的Cu和HNO3的物质的量之比为3:10,写出并配平该反应的离子方程式3Cu+10H++4NO3-=3Cu2++NO↑+3NO2↑+5H2O.
分析 (1)根据硝酸反应生成硝酸盐及硝酸中N元素的化合价变化来分析;
(2)利用电子守恒来计算作氧化剂的硝酸的物质的量,作酸性和作氧化剂的物质的量之和为参加反应的硝酸的物质的量,再根据NO不溶于水,3NO2+H2O═2HNO3+NO;
(3)根据电子守恒及质量守恒定律来并配平该反应的离子方程式.
解答 解:(1)在该反应中硝酸反应生成硝酸盐,且硝酸中N元素的化合价降低,则作氧化剂,硝酸在反应中被还原,则对应的产物NO、NO2为还原产物,
故答案为:氧化性、酸性;
(2)设NO的物质的量为n,得到的NO和NO2物质的量相同,
由电子守恒可知,0.3mol×2=n×(5-2)+n×(5-4),
解得n=0.15mol,
则N原子守恒可知作氧化剂的硝酸为0.15mol+0.15mol=0.3mol,
由Cu(NO3)2可知,作酸性的硝酸为0.3mol×2=0.6mol,
则参加反应的硝酸的物质的量是0.3mol+0.6mol=0.9mol,
由3NO2+H2O═2HNO3+NO可知,0.15molNO2与水反应生成0.05molNO,
则用排水法收集这些气体,最后气体为NO,其物质的量为0.15mol+0.05mol=0.2mol,
在标准状况下,气体的体积为0.2mol×22.4L/mol=4.48L,
故答案为:0.9;4.48;
(3)Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O中,参加反应的Cu和HNO3的物质的量之比是3:10,
则3Cu+10HNO3→3Cu(NO3)2+xNO↑+yNO2↑+5H2O,
由电子守恒及N原子守恒可得,
$\left\{\begin{array}{l}{3x+y=6}\\{x+y=4}\end{array}\right.$,解得x=1,y=3,
则配平的化学反应为3Cu+10HNO3═3Cu(NO3)2+NO↑+3NO2↑+5H2O,
单质、气体、水在离子方程式中保留化学式,其离子反应为3Cu+10H++4NO3-=3Cu2++NO↑+3NO2↑+5H2O,
故答案为:3Cu+10H++4NO3-=3Cu2++NO↑+3NO2↑+5H2O.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化来分析氧化还原反应是关键,并利用电子守恒、质量守恒定律等来进行相关计算即可解答,

| A. | 质谱 | B. | 红外光谱 | C. | 紫外光谱 | D. | 核磁共振谱 |
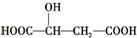 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
| A. | R为第ⅣA族元素 | B. | R的气态氢化物为H2R | ||
| C. | R能形成含氧酸H2RO4 | D. | R气态氢化物水溶液呈碱性 |
 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.(一)用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+=4Fe3++2H2O.FeSO4在水中的溶解度见图.
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,分离出液体的方法通常不用过滤,使用的操作是倾析法(填写操作名称).
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液.温度宜控制在60℃左右;加热的同时需适当补充水,原因是防止硫酸亚铁晶体析出.反应中应保持n(Fe)/n(H2SO4)>1(填“<”、“>”或“=”).
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在.如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是防止硫酸亚铁水解.
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 4.4 |
(5)反应Ⅱ中反应的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )| A. | 每生成2molAB分子吸收b kJ热量 | |
| B. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 1molA-A键和1molB-B键的总键能高于2molA-B键的总键能 |
| A. | 强电解质溶液的导电能力一定大于弱电解质溶液的导电能力 | |
| B. | 溶于水能导电的化合物都是电解质 | |
| C. | 25℃时,0.1mol/L的盐酸中氢离子浓度大于0.1mol/L的醋酸中氢离子浓度 | |
| D. | BaSO4属于强电解质,所以其水溶液导电能力很强 |
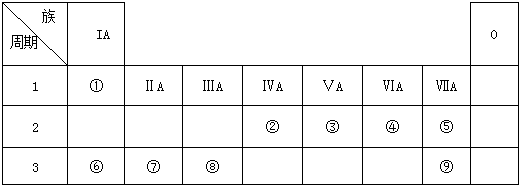
 .
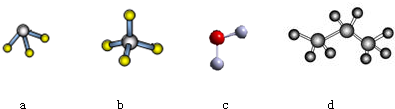
.
 元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是
元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是 .
.