题目内容
11.下表是稀硫酸与某金属反应的实验数据:| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4)/mol•L-1 | v(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)实验4和5表明固体反应物的表面积对反应速率有影响.
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填实验序号).
(3)其实验6和其实验7表明温度对反应速率有影响.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:可能是硫酸过量,等质量的金属完全反应,放出的热量相等,所以使等体积溶液的温度升高值相近.
分析 影响化学反应速率的因素很多:
固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越小,固体反应物的表面积越小,化学反应速率降低;
反应物的浓度,在其他条件相同时,增大反应物的浓度,化学反应速率加快;减小反应物的浓度,反应速率降低;
反应物的温度,在其他条件相同时,升高反应物的温度,化学反应速率加快;降低反应物的温度,反应速率降低.
解答 解:(1)观察实验4和5,金属和稀硫酸的量相同,金属的状态不同,可知固体的表面积越大反应速率越快,
故答案为:固体反应物的表面积;
(2)仅表明反应物浓度对反应速率产生影响的实验,金属的状态就应该相同,或者为丝状,或者为粉末,
故答案为:1、3、4;
(3)实验6和7只有温度不同,其他相同,实验是探究温度对反应速率的影响,故答案为:温度;
(4)金属质量相等,如完全反应,放出的热量相同,则温度升高数值相等,
故答案为:可能是硫酸过量,等质量的金属完全反应,放出的热量相等,所以使等体积溶液的温度升高值相近.
点评 本题考查影响化学反应速率的因素.固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越大,固体反应物的表面积越小,化学反应速率降低.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
1.每年的6月26日是国际禁毒日.如图所示是四种毒品的结构简式,下列有关说法正确的是( )

| A. | 四种毒品中都含有苯环,都属于芳香烃 | |
| B. | 摇头丸经消去、加成反应可制得冰毒 | |
| C. | 1mol大麻与溴水反应最多消耗4mol Br2 | |
| D. | 氯胺酮分子中环上所有碳原子可能共平面 |
2.下列有机物在核磁共振氢谱上只有一组峰的是( )
| A. | HCHO | B. | CH3OH | C. | HCOOH | D. | CH3COOCH3 |
19.可逆反应:在密闭容器反应2NO2?2NO+O2,达到平衡状态的标志是( )
(1)单位时间内生成2moL NO2的同时生成2moL NO
(2)单位时间内生成2moL NO的同时,生成1moL O2
(3)用反应物和生成物的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
(1)单位时间内生成2moL NO2的同时生成2moL NO
(2)单位时间内生成2moL NO的同时,生成1moL O2
(3)用反应物和生成物的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
| A. | (1)(4)(5) | B. | (2)(3)(5) | C. | (1)(3)(4) | D. | (1)(2)(3)(4)(5) |
6.下列说法错误的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 双原子单质分子中的共价键一定是非极性键 |

 ;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
;化合物甲与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
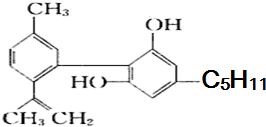 大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构为:
大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构为: ,它与足量的溴水反应最多消耗Br23mol.
,它与足量的溴水反应最多消耗Br23mol.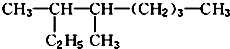 的名称是3,4-二甲基辛烷
的名称是3,4-二甲基辛烷 .
.