题目内容
14.下列微粒中半径最小的( )| A. | Na+ | B. | Al3+ | C. | K+ | D. | S2- |
分析 电子层结构相同,核电荷数越大离子半径越小,电子层越多离子微粒半径越大.
解答 解:S2-、K+、均含有3个电子层,Na+、Al3+离子含有2个电子层,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->K+>Na+>Al3+,故Al3+离子半径最小,故选B.
点评 本题考查微粒数目的比较,比较基础,明确微粒半径的比较规律即可解答,注意从结构上理解半径大小.

练习册系列答案
相关题目
4.下列表述正确的是( )
| A. | 羟基的电子式 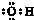 | B. | 醛基的结构简式-COH | ||
| C. | 1-丁烯的键线式  | D. | 聚丙烯的结构简式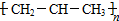 |
5.元素的性质呈现周期性变化的根本原因是( )
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 第一电离能呈周期性变化 |
2.已知某原子的结构示意图为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该元素位于第3周期第ⅡA族 | B. | 该元素位于第2周期第Ⅷ族 | ||
| C. | 该元素位于第2周期第ⅡA族 | D. | 该元素位于第4周期第ⅡB族 |
9.同主族元素形成的同一类型化合物,往往其结构和性质相似.PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是( )
| A. | 它是一种共价化合物 | B. | 它不可能与NaOH溶液反应 | ||
| C. | 它既含离子键又含共价键 | D. | 它受热时不会分解 |
6.下列关于元素的叙述正确的是( )
| A. | 金属元素与非金属元素能形成共价化合物 | |
| B. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 多电子原子中,在离核较近的区域内运动的电子能量较高 |
4.下列事实不能用平衡移动原理解释的是( )
| A. | 用排饱和食盐水法收集Cl2 | |
| B. | 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 | |
| C. | 加入催化剂可以提高原料转化率,生成更多产物 | |
| D. | 分别用等体积的蒸馏水和0.01mol/L的硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量 |
 短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题
短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题 ②CH3CH2CH(CH3)CH3 ③CH4 ④
②CH3CH2CH(CH3)CH3 ③CH4 ④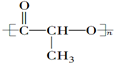 ⑤
⑤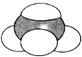 ⑥
⑥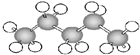 ⑦
⑦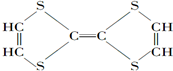
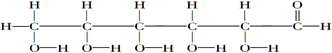
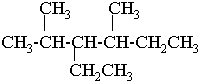
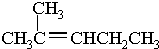 .
.