7.工业制硫酸中的一步重要反应是SO2在400~600℃下的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| C. | 无论怎样控制反应条件,2 mol SO2与1 mol O2 反应时都不会生成2 mol SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
6.有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为( )
| A. | A>B>C>D | B. | B>D>C>A | C. | C>A>B>D | D. | A>C>D>B |
5.短周期元素W、X、Y、Z在元素周期表中的位置如图所示.下列说法中,正确的是( )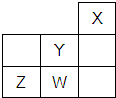

| A. | Y的原子半径在同周期主族元素中最大 | |
| B. | W的非金属性比Z的弱 | |
| C. | Z的气态氢化物的稳定性在同主族元素中最强 | |
| D. | W的最高价氧化物对应的水化物是强酸 |
4.在某一化学反应中,生成物B的浓度在10s内从1.5mol/L变成2.0mol/L,则这10s内用B的浓度变化表示的化学反应速率为( )
| A. | 0.05mol/(L•s) | B. | 0.05mol/L | C. | 0.20 mol/(L•s) | D. | 0.20mol/L |
3.下列说法中正确的是( )
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 在同一周期中,ⅠA族单质的活泼性比ⅡA族的弱 | |
| C. | 所有主族元素的最高化合价数与它的族序数数值相等 | |
| D. | 同主族元素的气态氢化物,相对分子质量越大,沸点不一定越高 |
2.下列叙述不正确的是( )
| A. | 电能是二次能源 | B. | 水力是一次能源 | ||
| C. | 天然气是一次能源 | D. | 蒸汽是一次能源 |
1.中国科学家首次在世界上发现铂的一种新原子78202Pt,下列说法不正确的是( )
| A. | 质量数202 | B. | 核外电子数202 | C. | 原子序数78 | D. | 核内有124个中子 |
19.工业生产硫酸过程中的一步反应是2SO2(g)+O2(g)?2SO3(g).如果该反应在密闭容器内进行,能说明该反应达到化学平衡状态的是( )
0 168243 168251 168257 168261 168267 168269 168273 168279 168281 168287 168293 168297 168299 168303 168309 168311 168317 168321 168323 168327 168329 168333 168335 168337 168338 168339 168341 168342 168343 168345 168347 168351 168353 168357 168359 168363 168369 168371 168377 168381 168383 168387 168393 168399 168401 168407 168411 168413 168419 168423 168429 168437 203614
| A. | SO2完全转化为SO3 | |
| B. | 消耗2 mol SO2的同时生成2 mol SO3 | |
| C. | SO2、O2与SO3的物质的量之比为2:1:2 | |
| D. | SO2、O2与SO3的浓度不再随时间变化 |
 短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.
短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.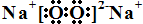 .
.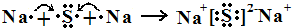 .
.