题目内容
5.短周期元素W、X、Y、Z在元素周期表中的位置如图所示.下列说法中,正确的是( )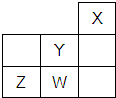
| A. | Y的原子半径在同周期主族元素中最大 | |
| B. | W的非金属性比Z的弱 | |
| C. | Z的气态氢化物的稳定性在同主族元素中最强 | |
| D. | W的最高价氧化物对应的水化物是强酸 |
分析 根据短周期元素W、X、Y、Z在元素周期表中的位置知,X、Y、Z、W分别是He、F、S、Cl元素,
A、同周期自左而右原子半径减小;
B、同一周期元素中,元素的非金属性随着原子序数的增大而增强;
C、元素的非金属性越强,其氢化物越稳定;
D、W为Cl,其最高价氧化物对应的水化物高氯酸是强酸.
解答 解:A、同周期自左而右原子半径减小,Y的原子半径在同周期主族元素中最小,故A错误;
B、同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以W的非金属性比Z的强,故B错误;
C、元素的非金属性越强,其氢化物越稳定,同一主族元素中,Z的非极性不是最强的,所以其氢化物不是最稳定的,故C错误;
D、Cl元素最高价氧化物对应的水化物是高氯酸,高氯酸是强酸,故D正确;故选D.
点评 本题考查元素周期表与元素周期律,难度不大,侧重对元素周期律的考查,注意整体把握元素周期表的结构.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
15.下列离子组一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 由水电离出c(H+)=10-3 mol•L-1的溶液中:Na+、AlO2-、NO3-、HCO3- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
16.下列排列顺序正确的是( )
| A. | 离子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
13.利用低品位软锰矿浆(主要成分是MnO2,少量的Fe3+、Al3+等)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体可实现资源的综合利用和环境治理.
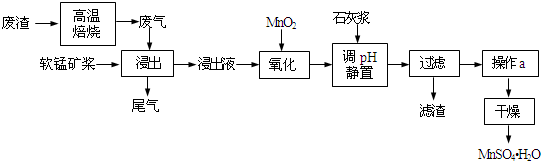
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
(1)写出浸出过程中主要反应的化学方程式SO2+MnO2=MnSO4.浸出过程中Fe3+转化为Fe2+,此转化的离子反应方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7~8.3.
②若加入的石灰浆过多,会使得MnSO4•H2O晶体中含有较多杂质,用离子反应方程式表示其原因Al(OH)3+3OH-═AlO2-+2H2O或Al3++4OH-═AlO2-+2H2O.
(4)下列各组试剂中,能准确测定尾气中SO2含量的是b、c(选填序号).
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液.

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7~8.3.
②若加入的石灰浆过多,会使得MnSO4•H2O晶体中含有较多杂质,用离子反应方程式表示其原因Al(OH)3+3OH-═AlO2-+2H2O或Al3++4OH-═AlO2-+2H2O.
(4)下列各组试剂中,能准确测定尾气中SO2含量的是b、c(选填序号).
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液.
15.我国科学家首次合成的一种过渡金属的新核素${\;}_{72}^{185}$Hf,具有延展性,不易被腐蚀,可应用于高科技领域等特点.185Hf可由180Hf转化而成,下列有关180Hf、185Hf的说法正确的是( )
| A. | 物质的量相等的185Hf与180Hf质量相同 | |
| B. | 核外电子数分别为108、113 | |
| C. | 1 mol 180Hf比1 mol 185Hf的中子数少5NA | |
| D. | 180Hf、185Hf在周期表中的位置不同 |
 短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.
短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色. .
.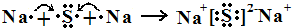 .
.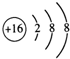 .
.