题目内容
7.工业制硫酸中的一步重要反应是SO2在400~600℃下的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法中错误的是( )| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| C. | 无论怎样控制反应条件,2 mol SO2与1 mol O2 反应时都不会生成2 mol SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
分析 A、使用催化剂加快了反应速率,缩短反应时间;
B、可逆反应,反应物不可能100%的转化;
C、可逆反应,反应物不可能100%的转化;
D、达到平衡时,SO2的浓度与SO3的浓度可能相等,也可能不相等.
解答 解:A、使用催化剂加快了反应速率,缩短反应时间,提高反应效率,平衡不移动,故A正确;
B、因该反应是可逆反应,存在反应限度,反应物不可能100%的转化,故B正确;
C、因该反应是可逆反应,反应物不可能100%的转化,所以无论怎样控制反应条件,2molSO2与1molO2反应时都不会生成2molSO3,故C正确;
D、达到平衡时,SO2的浓度与SO3的浓度可能相等,也可能不相等,要依据反应物的初始浓度及转化率,故D错误;
故选D.
点评 本题考查了影响化学平衡移动的因素,难度不大,注意影响化学反应速率和化学平衡的影响因素分析判断.

练习册系列答案
相关题目
17.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. |  用图分离两种互溶但沸点相差较大的液体混合物 | |
| B. |  用图所示装置可除去NO2中的NO | |
| C. |  用图检验铁粉与水蒸气反应产生的氢气 | |
| D. | 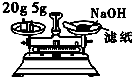 用图称量氢氧化钠固体 |
18.向某一固定体积的密闭容器中充入NO2,在一定条件下进行反应:2NO2?2NO+O2.达到平衡状态的标志是( )
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1.
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1.
| A. | ①② | B. | ③④ | C. | ①④ | D. | ②③ |
15.25℃时,下列有关CH3COOH和CH3COONa溶液关系正确的是( )
| A. | 适当加热CH3COONa溶液,c(OH-)会增大 | |
| B. | 0.10mol/L的CH3COOH溶液稀释10倍后:pH=2 | |
| C. | 0.10mol/L的CH3COONa溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH) |
2.下列叙述不正确的是( )
| A. | 电能是二次能源 | B. | 水力是一次能源 | ||
| C. | 天然气是一次能源 | D. | 蒸汽是一次能源 |
12.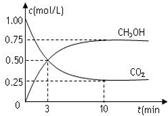 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 进行到3分钟时,正反应速率和逆反应速率相等 | |
| B. | 从反应开始到平衡,氢气的平均反应速率为0.225mol•L-1•min-1 | |
| C. | 达到平衡后,升高温度,正反应速率增大、逆反应速率减小 | |
| D. | 3min前v正>v逆,3min后v正<v逆 |
19.下列事实中能说明醋酸是弱电解质的是( )
| A. | 用醋酸溶液作导电试验,灯光较暗 | |
| B. | 醋酸(CH3COOH)是共价化合物 | |
| C. | 醋酸不与氯化钠反应 | |
| D. | 常温下1 mol?L-1醋酸溶液的c(H+)约为0.004 mol•L-1 |
16.如图有关原子或离子的结构示意图表示正确的是( )
| A. | 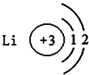 | B. | 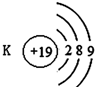 | C. | 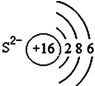 | D. | 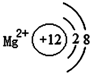 |