题目内容
6.有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为( )| A. | A>B>C>D | B. | B>D>C>A | C. | C>A>B>D | D. | A>C>D>B |
分析 活泼性较强的金属作原电池的负极,易失去电子而被氧化;原电池中电子从负极流经外电路流向正极,金属的活泼性只取决于失电子的能力,与失电子多少无关,以此解答该题.
解答 解:①活泼性较强的金属作原电池的负极,A、B用导线相连后,同时插入稀H2SO4中,A极为负极,则活泼性:A>B;
②原电池中电子从负极流经外电路流向正极,C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D,则活泼性:C>D;
③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡,说明C为原电池的正极,较不活泼,则活泼性:A>C;
④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,应为原电池的负极,则活泼性:D>B,
所以有:A>C>D>B,
故选D.
点评 本题考查金属活泼性的比较,为高频考点,题目难度不大,本题注意把握如何从原电池的角度比较金属的活泼性,注意原电池中,较为活泼的金属作负极.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.常温下,下列有关溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 向0.1mol•L-1pH=2的HF溶液加水稀释,c(H+)c(HF)增大 | |
| B. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的NH3•H2O溶液和NH4Cl溶液等体积混合:c(NH4+)+c(NH3•H2O)=2c(Cl-) | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
17.苯环上有两个取代基的C9H12,其一氯代物的同分异构体共有( )
| A. | 9种 | B. | 16种 | C. | 19种 | D. | 22种 |
1.中国科学家首次在世界上发现铂的一种新原子78202Pt,下列说法不正确的是( )
| A. | 质量数202 | B. | 核外电子数202 | C. | 原子序数78 | D. | 核内有124个中子 |
11.以下叙述错误的是( )
| A. | 氢气与氯气反应后,体系的能量降低 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 若生成物的总能量高于反应物的总能量,则反应过程吸收能量 | |
| D. | 化学反应的实质是旧化学键的断裂和新化学键的形成 |
18.下列说法正确的是( )
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有自发进行的化学反应都是放热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
15.根据原子结构的相关知识可知,不同种元素的本质区别是( )
| A. | 质子数不同 | B. | 中子数不同 | C. | 电子数不同 | D. | 质量数不同 |
16.如表为元素周期表中短周期的一部分,关于A、B、C、D、E的说法正确的是( )
| A | ||
| B | C | |
| D | E |
| A. | E的单质可与D的氢化物反应制得D的单质,所以非金属性:E>D | |
| B. | 对应的离子半径:E>D>C | |
| C. | 对应氢化物的熔沸点:B>D,因为B的氢化物分子内存在氢键 | |
| D. | B、C、D、E四种元素中,C的最高价氧化物对应的水化物酸性最强 |

 ,②
,② 中氯原子较难水解.
中氯原子较难水解. 或
或 .
. .
.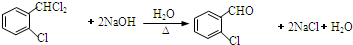 .
. .
. .
. ,写出由乙烯、甲醇为有机原料制备化合物
,写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH