9.下列关于碱金属元素说法正确的是( )
| A. | 单质都能在O2中燃烧生成过氧化物 | |
| B. | 从Li到Cs,密度越来越大,熔点越来越低 | |
| C. | 单质都可以保存在煤油中 | |
| D. | 单质都是强还原剂,与水反应都生成强碱 |
8.下列关于化学用语的表示正确的是( )
| A. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| B. | 过氧化钠的电子式: | |
| C. | 硫离子的结构示意图: | |
| D. | 苯的结构简式:C6H6 |
7.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A. | 第一电离能:Y可能大于或小于X | |
| B. | 气态氢化物的稳定性:HmY强于HnX | |
| C. | 最高价含氧酸的酸性X强于Y | |
| D. | X和Y形成化合物时,X显负价Y显正价 |
6.下列电子式错误的是( )
| A. |  | B. |  | C. | 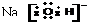 | D. |  |
5.下列叙述中,错误的是( )
| A. | 原子半径:Na>Mg>O | |
| B. | 13C和14C属于同位素 | |
| C. | 0族元素是同周期中非金属性最强的元素 | |
| D. | N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强 |
1. 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )| A. | 分子中5个R-Cl键键能不都相同 | |
| B. | 键角(Cl-R-Cl)有90°、120、180°几种 | |
| C. | RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3 | |
| D. | 每个原子都达到8电子稳定结构 |
20.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
(4)白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.已知298K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2 983.2kJ•mol-1.在298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1.在某密闭容器中加入62g白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应.则所得到的P4O10与P4O6的物质的量之比为3:1,反应过程中放出的热量为1323.45 kJ.
0 168162 168170 168176 168180 168186 168188 168192 168198 168200 168206 168212 168216 168218 168222 168228 168230 168236 168240 168242 168246 168248 168252 168254 168256 168257 168258 168260 168261 168262 168264 168266 168270 168272 168276 168278 168282 168288 168290 168296 168300 168302 168306 168312 168318 168320 168326 168330 168332 168338 168342 168348 168356 203614
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
| X | ||||
| R |
 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.