题目内容
6.下列电子式错误的是( )| A. |  | B. |  | C. | 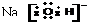 | D. |  |
分析 A、氯化钠为离子化合物;
B、CCl4是共价化合物,每个Cl原子与C原子之间形成一对共用电子对;
C、NaOH是离子化合物,在该化合物中存在离子键、极性共价键;
D、HClO是共价化合物,O原子分别与一个H、Cl原子重新一对共用电子对.
解答 解:A.NaCl是离子化合物,在阴阳离子之间存在离子键,电子式是: ,故A正确;
,故A正确;
B.CCl4是共价化合物,每个Cl原子与C原子之间形成一对共用电子对,电子式为 ,故B正确;
,故B正确;
C.NaOH是离子化合物,在该化合物中存在离子键、极性共价键,钠离子带一个单位正电荷,电子式为: ,故C错误;
,故C错误;
D.HClO是共价化合物,O原子分别与一个H、Cl原子重新一对共用电子对,达到每个原子的稳定结构,电子式为: ,故D正确,故选C.
,故D正确,故选C.
点评 本题主要考查的是电子式的书写与判断,判断物质属于离子化合物还是共价化合物是关键.

练习册系列答案
相关题目
17.“N原子2P轨道上有3个未成对电子”,支撑这一结论的理论是( )
| A. | 构造原理 | B. | 泡利原理 | C. | 洪特规则 | D. | 能量最低原理 |
1. 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )| A. | 分子中5个R-Cl键键能不都相同 | |
| B. | 键角(Cl-R-Cl)有90°、120、180°几种 | |
| C. | RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3 | |
| D. | 每个原子都达到8电子稳定结构 |
15.下列烃中经催化加氢,不能得到2-甲基丁烷的是( )
| A. | 2-甲基-1-丁烯 | B. | 2-甲基-2-丁烯 | ||
| C. | 3-甲基-1-丁炔 | D. | 3,3-二甲基-1-丁炔 |
 分析图,回答以下问题:
分析图,回答以下问题: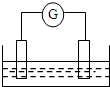 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题: .
. 实验室用图示装置制取乙酸乙酯.
实验室用图示装置制取乙酸乙酯.