题目内容
3.A、B、C、D、E均是短周期元素,A和B同周期,A和C同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与D的阳离子电子层结构相同,D的单质与B的单质在不同条件下反应,可生成D2B或D2B2,D在E的单质中燃烧产生苍白色火焰,请回答.(1)C在元素周期表中的位置是第三周期第ⅣA族.
(2)D2B2的电子式是
 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.(3)B、D、E离子半径的由大到小的顺序为Cl->O2->Na+;(用离子符号回答)A的最高价氧化物通入由B、C、D三种元素组成的盐溶液中有胶状沉淀生成,写出正确的化学反应方程式Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
(4)水中锰含量超标,容易使洁具和衣物染色,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀,当消耗13.50g EB2时,共转移了1mol电子,则反应的离子方程式为5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+.
分析 A、B、C、D、E均是短周期元素,A和B同周期,A原子最外层电子数是内层电子数的二倍,则A为碳元素,A和C同族,则C为硅元素,B元素族序数是周期数的三倍,则B为氧元素,B的阴离子与D的阳离子电子层结构相同,D的单质与B的单质在不同条件下反应,可生成D2B或D2B2,则D为钠元素,D在E的单质中燃烧产生苍白色火焰,则E为氯元素,据此答题.
解答 解:A、B、C、D、E均是短周期元素,A和B同周期,A原子最外层电子数是内层电子数的二倍,则A为碳元素,A和C同族,则C为硅元素,B元素族序数是周期数的三倍,则B为氧元素,B的阴离子与D的阳离子电子层结构相同,D的单质与B的单质在不同条件下反应,可生成D2B或D2B2,则D为钠元素,D在E的单质中燃烧产生苍白色火焰,则E为氯元素,
(1)C为硅元素,在元素周期表中第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(2)D2B2为过氧化钠,它的电子式是; ;AB2为二氧化碳,它的结构式是O=C=O,故答案为:
;AB2为二氧化碳,它的结构式是O=C=O,故答案为: ;O=C=O;
;O=C=O;
(3)电子层数越多,离子半径越大,电子层数相同时,核电荷数越小,离子半径越大,所以B、D、E离子半径的由大到小的顺序为Cl->O2->Na+;A的最高价氧化物为二氧化碳,通入由B、C、D三种元素组成的盐溶液中有胶状沉淀生成,则该盐溶液为Na2SiO3,化学反应方程式为Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,
故答案为:Cl->O2->Na+;Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓;
(4)水中锰含量超标,容易使洁具和衣物染色、使水产生异味.ClO2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,该黑色沉淀为MnO2,同时测得消耗13.50g ClO2时,共转移了1mol电子,令Cl元素在还原产物中的化合价为a,则$\frac{13.5g}{67.5g/mol}$×(4-a)=1,解得a=-1,故生成Cl-,根据电荷守恒可知,还生成H+,则反应的离子方程式是5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+,故答案为:5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+.
点评 本题主要考查了元素周期表、电子式、元素周期律、氧化还原反应等知识点,中等难度,元素推断是解题的关键,第(4)为易错点,答题时注意运用守恒的思想解决问题.

 考前必练系列答案
考前必练系列答案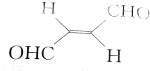 ,下列叙述正确的有( )
,下列叙述正确的有( )| A. | 分子间可形成氢键 | B. | 分子中既有极性键又有非极性键 | ||
| C. | 分子中有7个σ键和1个π键 | D. | C原子的杂化方式是sp2和sp3 |

下列说法正确的是( )
| A. |  能与Na2CO3溶液反应生成CO2 能与Na2CO3溶液反应生成CO2 | B. |  与BHT互为同系物 与BHT互为同系物 | ||
| C. | BHT久置于空气中不会被氧化 | D. | 两种方法的反应类型都是加成反应 |
| A. | 25℃101 kPa时,2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1此反应的反应热为221 kJ•mol-1 | |
| B. | 氢气的燃烧热为285.8 kJ•mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |
| C. | 已知2SO2(g)+O2(g)═2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 | |
| D. | 稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1稀硝酸与稀Ba(OH)2溶液反应的中和热为57.3 kJ•mol-1 |
| A. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| B. | 过氧化钠的电子式: | |
| C. | 硫离子的结构示意图: | |
| D. | 苯的结构简式:C6H6 |
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
| A. | 已知t1>t2,HX的生成反应为放热反应 | |
| B. | 在相同条件下,X2平衡转化率a:F2>Cl2 | |
| C. | X2与H2反应的剧烈程度随着原子序数递增逐渐减弱 | |
| D. | HX的稳定性:HBr>HI |

| A. | M上有气体放出 | |
| B. | M为负极,N为正极 | |
| C. | 化学能转变为电能的装置 | |
| D. | 导线中有电流通过,电流方向由N到M |
 新合成的一种烃,其碳架呈三棱柱体(如图所示)
新合成的一种烃,其碳架呈三棱柱体(如图所示) .
.