题目内容
7.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )| A. | 第一电离能:Y可能大于或小于X | |
| B. | 气态氢化物的稳定性:HmY强于HnX | |
| C. | 最高价含氧酸的酸性X强于Y | |
| D. | X和Y形成化合物时,X显负价Y显正价 |
分析 同周期自左而右元素的电负性增大,非金属性增强,电负性X>Y,则非金属性X>Y.
A.一般非金属性强的,但原子各能级处于全满、半满稳定状态时,能量较低,第一电离能高于同周期相邻元素;
B.非金属性越强,气态氢化物越稳定;
C.非金属性越强,其最高价氧化物的水化物的酸性越强,但O、F除外;
D.电负性越大,对电子吸引力越大,化合时表现负化合价.
解答 解:X、Y元素同周期,且电负性X>Y,则非金属性X>Y.
A.一般非金属性强的,其第一电离能大,但原子各能级处于全满、半满稳定状态时,能量较低,第一电离能高于同周期相邻元素,第一电离能:Y可能大于X,如N>O等,故第一电离能:Y可能大于或小于X,故A正确;
B.若X、Y均为非金属,元素的非金属性越强,其气态氢化物的稳定性越强,非金属性X>Y,则气态氢化物的稳定性:HmY小于HnX,故B错误;
C.同周期元素,电负性X>Y,故非金属性X>Y,非金属性越强,最高价含氧酸的酸性越强,故C正确;
D.电负性X>Y,则X元素对电子吸引力更强,与Y化合时X表现负价,Y表现正价,故D正确,
故选B.
点评 本题考查元素周期律,难度不大,同时考查学生运用元素周期律能力,注意第一电离能规律中的异常现象.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
17.下列叙述正确的是( )
| A. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡后静置,下层液体未褪色 | |
| C. | 1mol苯能与3mol H2发生加成反应,说明在苯环中含有3个双键 | |
| D. | 用冰冷却苯,苯可以凝结成无色的晶体 |
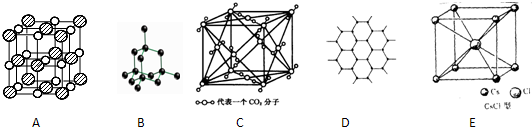
18.下列关于晶体的说法正确的是( )
| A. | 晶体中只要有阳离子就一定有阴离子 | |
| B. | 氢键属于分子间作用力,不存在于分子内 | |
| C. | 原子晶体的熔点一定比金属晶体的高 | |
| D. | 构成分子晶体的微粒不一定含有共价键 |
12.下表列出了A-R九种元素在周期表中的位置,用元素符号或化学式填空.
(1)这九种元素中:
化学性质最不活泼的是Ar;
金属性最强的是K;
最高价氧化物的水化物碱性最强的碱是KOH;
最高价氧化物的水化物酸性最强的酸是HClO4.
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为K>Na>Mg.
(4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
(5)H元素跟A元素形成的化合物的化学式是NaBr;A2F2的电子式是 ;.
;.
(6)B和F两种元素形成的2:1型化合物属于离子化合物(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程 .
.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
化学性质最不活泼的是Ar;
金属性最强的是K;
最高价氧化物的水化物碱性最强的碱是KOH;
最高价氧化物的水化物酸性最强的酸是HClO4.
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为K>Na>Mg.
(4)F的氢化物的电子式
 ;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
;G、H 氢化物的稳定性递减的顺序是HCl>HBr.(5)H元素跟A元素形成的化合物的化学式是NaBr;A2F2的电子式是
 ;.
;.(6)B和F两种元素形成的2:1型化合物属于离子化合物(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程
 .
.
16.油酸的结构简式为CH3(CH2)7CH=CH(CH2)7COOH,下列说法正确的是( )
| A. | 油酸的分子式为C18H33O2 | B. | 油酸是乙酸的同系物 | ||
| C. | 油酸可与氢气发生加成反应 | D. | 1 mol甘油最多可与1 mol油酸酯化 |
17.下列有关化学用语正确的是( )
| A. | Cl-离子的结构示意图: | B. | 甲烷的结构式为: | ||
| C. | 丙烷分子的比例模型示意图: | D. | 乙醇的分子式:CH3CH2OH |
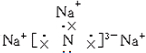 ,该化合物由离子键形成.
,该化合物由离子键形成.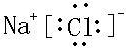 ,
, .
.