题目内容
5.下列叙述中,错误的是( )| A. | 原子半径:Na>Mg>O | |
| B. | 13C和14C属于同位素 | |
| C. | 0族元素是同周期中非金属性最强的元素 | |
| D. | N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强 |
分析 A.一般来说原子核外电子层数越多,原子半径越大,同周期元素自左向右原子半径逐渐减小,故A正确;
B.质子数相同、中子数不同的原子互为同位素;
C.同周期非金属性最强的元素位于第ⅦA;
D.非金属性越强,相应最高价氧化物对应水化物的酸性就越强.
解答 解:A.同周期元素自左向右原子半径逐渐减小,则Na>Mg,一般来说原子核外电子层数越多,原子半径越大,O原子半径最小,故A正确;
B.13C和14C的质子数相同,质量数不同,所以这两种核素互称为同位素,故B正确;
C.同周期元素从左到右元素的非金属性逐渐增强,同周期非金属性最强的元素位于第ⅦA,0族元素活泼性较弱,故C错误;
D.同主族元素自上而下非金属性是减弱的,非金属性越强,相应最高价氧化物对应水化物的酸性就越强,故D正确.
故选C.
点评 本题考查元素周期率知识,为高考常见题型和高频考点,侧重于元素对应单质、化合物的性质的递变规律的考查,注意把握性质的递变规律,难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
15.原子序数依次增大的X,Y,Z,W四种短周期元素,X,W原子的最外层电子数与其电子层数相等,X,Z的最外层电子数之和与Y,W的最外层电子数之和相等.甲的化学式为YX3,是一种具有刺激性气味的气体,乙是由X,Y,Z组成的盐.下列说法正确的是( )
| A. | 由X,Y,Z组成的盐的水溶液中阳离子总浓度大于阴离子总浓度 | |
| B. | YX3的水溶液呈弱碱性,能使湿润的蓝色石蕊试纸变红 | |
| C. | X与Z形成的化合物的水溶液可用于雕刻玻璃 | |
| D. | W的氯化物熔点低,易升华,但其水溶液能导电,由此推断它属于弱电解质 |
20.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
(4)白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.已知298K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2 983.2kJ•mol-1.在298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1.在某密闭容器中加入62g白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应.则所得到的P4O10与P4O6的物质的量之比为3:1,反应过程中放出的热量为1323.45 kJ.
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
| X | ||||
| R |
10.下列各组中属于同位素关系的是( )
| A. | 金刚石与石墨 | B. | T2O与H2O | C. | 40K与39K | D. | 16O与16O2- |
14.阿斯匹林的结构简式为: 则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )
则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )
 则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )
则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;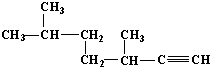 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔;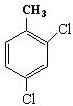 ;
; ,分子式为C15H22O2;
,分子式为C15H22O2;  中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基.
 ;
; .
. ,反应类型取代反应.
,反应类型取代反应.