题目内容
20.回答下列问题:(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
| X | ||||
| R |
分析 (1)根据物质的量与热量的关系以及热化学方程式的书写方法来解答;
(2)根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热
(3)由短周期元素,X元素最低负化合价的绝对值等于其原子的最外层电子数,设最外层电子数为x,则有8-x=x,x=4,则X为C元素,根据在元素周期表的相对位置可知R为S元素;
(4)设P4O10物质的量为x,P4O6物质的量为y,结合原子守恒计算得到,依据热化学方程式计算反应放出的热量.
解答 解:(1)中和热是指在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,则中和热的热化学方程式为:1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/cm3=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为:Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-$\frac{1.3376kJ}{0.025mol}$=-53.5kJ/mol;用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,氨水是弱电解质,电离吸热,导致测得的中和热的数值会偏小;
故答案为:-53.5kJ/mol;偏小;
(3)由短周期元素,X元素最低负化合价的绝对值等于其原子的最外层电子数,设最外层电子数为x,则有8-x=x,x=4,则X为C元素,根据在元素周期表的相对位置可知R为S元素;由X和R形成的液态化合物为CS2,根据燃烧热可写出反应的热化学方程式为
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol;CS2是直线型分子,其结构式为S=C=S;
故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol;S=C=S;
(4)在某密闭容器中加入62g白磷和50.4L氧气(标准状况),白磷中磷原子物质的量=$\frac{62g}{31g/mol}$=2mol原子,氧气物质的量=$\frac{50.4L}{22.4L/mol}$=2.25mol,含有4.5mol氧原子;依据原子守恒列式计算:设P4O10物质的量为x,P4O6物质的量为y
$\left\{\begin{array}{l}{4x+4y=2mol}\\{5x+3y=2.25mol}\end{array}\right.$
计算出x=0.375mol,y=0.125mol
最后生成0.375molP4O10,0.125molP4O6mol,故物质的量之比为3:1;
P4(白磷,s)+3O2(g)═P4O6(s)△H=-1 638kJ•mol-1;
P4(白磷,s)+5O2(g)═P4O10(s)△H1=-2 983.2kJ•mol-1;
放出的热量=0.375mol×(-2983.2KJ/mol)+0.125 mol×(-1638KJ/mol)=1323.45kJ;
故答案为:3:1;1323.45 kJ.
点评 本题考查了物质结构分析,热化学方程式书写和盖斯定律计算应用,原子守恒和化学方程式的计算方法应用,掌握基础是关键,题目难度中等.

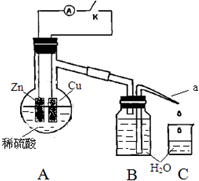 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热△H=-158kJ/mol.
(4)该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
| A. | 三种 | B. | 四种 | C. | 五种 | D. | 六种 |
| A. | 原子半径:Na>Mg>O | |
| B. | 13C和14C属于同位素 | |
| C. | 0族元素是同周期中非金属性最强的元素 | |
| D. | N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强 |
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
化学性质最不活泼的是Ar;
金属性最强的是K;
最高价氧化物的水化物碱性最强的碱是KOH;
最高价氧化物的水化物酸性最强的酸是HClO4.
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为K>Na>Mg.
(4)F的氢化物的电子式
 ;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
;G、H 氢化物的稳定性递减的顺序是HCl>HBr.(5)H元素跟A元素形成的化合物的化学式是NaBr;A2F2的电子式是
 ;.
;.(6)B和F两种元素形成的2:1型化合物属于离子化合物(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程
 .
. | A. | 1,3-丁二烯(CH2=CH-CH=CH2)与等物质的量的Br2发生加成反应 | |
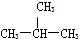
| B. | 2-氯丁烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下与足量硝酸发生硝化反应 | |
| D. | 乙醇与HBr发生的取代反应 |
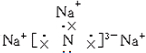 ,该化合物由离子键形成.
,该化合物由离子键形成.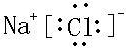 ,
, .
.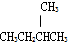 D、
D、 和
和 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和