19.下面关于化学反应的限度的叙述中,正确的是( )
| A. | 化学反应的限度都相同 | |
| B. | 化学反应的限度可以改变 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到限度时,反应即停止 |
18.在一定条件下,对于密闭容器中进行的可逆反应:N2(g)+3H2(g)?2NH3(g).下列说法中,表明这一反应已经达到化学平衡状态的是( )
| A. | N2、H2、NH3的浓度不再变化 | B. | N2、H2、NH3的浓度为1﹕3﹕2 | ||
| C. | N2、H2、NH3在密闭容器中共存 | D. | 反应停止,正、逆反应速率都等于0 |
17.下列事实不能用键能的大小来解释的是( )
| A. | N元素的电负性较大,但N2的化学性质很稳定 | |
| B. | 稀有气体一般难发生反应 | |
| C. | HF比H2O稳定 | |
| D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
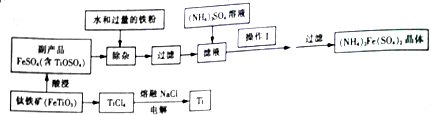
15.钡盐行业生产中排出大量的钡泥 主要含有【BaCO3、BaSiO3、BaSO3、Ba(FeO2)2】等.某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下
已知部分离子沉淀所需的pH如下表
问答下列问题
(1)上述③过滤操作中除要用到玻璃棒,铁架台,烧杯等还缺的玻璃仪器有漏斗,废渣中的主要化学物质是BaSiO3、H2SiO3、Fe(OH)3、BaSO4(写化学式)
(2)写出酸溶过程中涉及氧化还原反应的离子方程式3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O
(3)该厂结合本厂实际,选用的X为BaCO3(填化学式);中和Ⅰ使溶液中Fe3+、H+(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)
(4)上述④洗涤的目的是减少废渣中可溶性钡盐对环境的污染.
(5)由于废渣给周围环境造成了一定的污染,该工厂想设计一个方案,将工厂废渣进行分离,并制备生产光导纤维的主要原材料,请你按示例简要设计实验分案(示例:取物质A$\stackrel{加热}{→}$$\stackrel{蒸发}{→}$ 得到物质B)
废渣$\stackrel{适量氢氧化钾}{→}$$\stackrel{搅拌过滤}{→}$滤液$\stackrel{加入足量盐酸}{→}$$\stackrel{搅拌过滤}{→}$$\stackrel{加热}{→}$二氧化硅.

已知部分离子沉淀所需的pH如下表
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.7 | 7.5 | 1.4 |
| 沉淀完全pH | 6.7 | 14 | 3.7 |
(1)上述③过滤操作中除要用到玻璃棒,铁架台,烧杯等还缺的玻璃仪器有漏斗,废渣中的主要化学物质是BaSiO3、H2SiO3、Fe(OH)3、BaSO4(写化学式)
(2)写出酸溶过程中涉及氧化还原反应的离子方程式3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O
(3)该厂结合本厂实际,选用的X为BaCO3(填化学式);中和Ⅰ使溶液中Fe3+、H+(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)
(4)上述④洗涤的目的是减少废渣中可溶性钡盐对环境的污染.
(5)由于废渣给周围环境造成了一定的污染,该工厂想设计一个方案,将工厂废渣进行分离,并制备生产光导纤维的主要原材料,请你按示例简要设计实验分案(示例:取物质A$\stackrel{加热}{→}$$\stackrel{蒸发}{→}$ 得到物质B)
废渣$\stackrel{适量氢氧化钾}{→}$$\stackrel{搅拌过滤}{→}$滤液$\stackrel{加入足量盐酸}{→}$$\stackrel{搅拌过滤}{→}$$\stackrel{加热}{→}$二氧化硅.
14. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
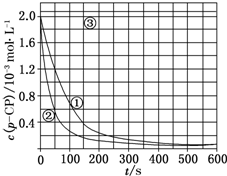
【数据处理】实验测得p-CP的浓度随时间变化的关系如图
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
12. 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:
请回答下列问题.
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1;
(2)C元素的第一电离能比氧元素的第一电离能大 (填“大”或“小”);
(3)CA3分子中C原子的杂化轨道类型是sp3;
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有①③ (填序号)
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d.V型
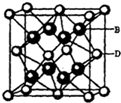
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$cm3 (写出表达式即可).
0 168157 168165 168171 168175 168181 168183 168187 168193 168195 168201 168207 168211 168213 168217 168223 168225 168231 168235 168237 168241 168243 168247 168249 168251 168252 168253 168255 168256 168257 168259 168261 168265 168267 168271 168273 168277 168283 168285 168291 168295 168297 168301 168307 168313 168315 168321 168325 168327 168333 168337 168343 168351 203614
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有一个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和EO两种氧化物 |
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1;
(2)C元素的第一电离能比氧元素的第一电离能大 (填“大”或“小”);
(3)CA3分子中C原子的杂化轨道类型是sp3;
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有①③ (填序号)
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$cm3 (写出表达式即可).