题目内容
14. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
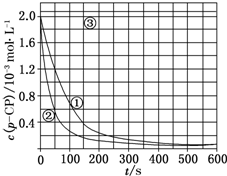
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
分析 (1)对比实验的基本思想是控制变量法,可以在温度相同时,变化浓度,或者在浓度相等时,变化温度;
(2)根据反应速率公式V=$\frac{△c}{△t}$计算平均反应速率;
(3)根据过氧化氢在温度较高时易分解的角度分析;
(4)根据图象曲线③的变化判断;
(5)根据曲线③中溶液pH对反应速率的影响角度判断改变的反应条件.
解答 解:(1)对比实验的关键是控制变量,实验②探究温度对降解反应速率的影响,则②中除了温度不同以外,其它量必须与实验①相同,则温度、双氧水浓度、亚铁离子浓度分别为:313K、6.0、0.30;实验③中除了pH与①不同外,其它量完全相同,则探究的是溶液的pH对降解反应速率的影响,
故答案为:
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 探究温度对降解反应速率的影响 | 313 | 6.0 | 0.30 | |
| ③ | 探究溶液的pH对降解反应速率的影响 | ||||
故答案为:8.0×10-6;
(3)温度较高时,过氧化氢不稳定易分解,所以温度过高时反而导致降解反应速率减小,
故答案为:过氧化氢在温度过高时迅速分解;
(4)通过图象曲线变化可知,当pH=10,随着时间的变化,其浓度基本不变,即反应速率趋向于零(或该降解反应趋于停止),说明pH等于10时的条件下,有机物p-CP不能降解,
故答案为:不能;
(5)根据曲线③可以得出,该反应在pH=10的溶液中停止,故可在反应液中加入碱溶液,使溶液的pH迅速增大,从而使反应停止,
故答案为:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
点评 本题考查化学反应速率的影响因素,题目难度中等,注意掌握影响化学反应速率的因素,明确设计对比实验时,只能改变一个条件,否则无法确定影响因素,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
4.下列物质中,不属于合成材料的是( )
| A. | 陶瓷 | B. | 橡胶 | C. | 塑料 | D. | 涤纶 |
19.下面关于化学反应的限度的叙述中,正确的是( )
| A. | 化学反应的限度都相同 | |
| B. | 化学反应的限度可以改变 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到限度时,反应即停止 |
3.今有A、B两种原子,A原子的M层比B原子的M层少2个电子,B原子的L层电子数为A原子L层电子数的2倍.A和B分别是( )
| A. | C和Mg | B. | Si和Na | C. | Cl和C | D. | B和He |


 ;
; 的系统命名为2,5-二甲基-3-乙基庚烷.
的系统命名为2,5-二甲基-3-乙基庚烷.