题目内容
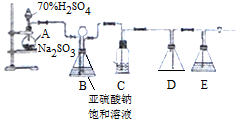
10.下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫.
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(2)如图中的甲和乙分别相当于工业上制取硫酸装置中的:接触室、吸收塔;
(3)写出在催化剂表面所发生反应的化学方程式2SO2+O2$?_{△}^{催化剂}$2SO3,在实验过程中不能持续加热的理由是该反应为放热反应,温度升高SO2转化率降低;温度过高催化剂活性降低;
(4)在乙反应容器内要求氧气的量要比二氧化硫的量多一倍左右,你是如何控制和估计的?可以通过调节气阀,控制气体流量,观察甲装置的冒泡速率进行估算.
(5)若丁装置在反应过程中先出现气泡,不久就出现了雾,而丙装置一直都没有任何现象,产生这种现象的原因可能是AC
A.浓硫酸对三氧化硫的吸收率远好于水,三氧化硫被浓硫酸充分吸收
B.三氧化硫的通气速率太快,三氧化硫未被水和浓硫酸充分吸收
C.丙中的导气管插得太深,导致两个吸收瓶内的气压差较大
D.丁中的导气管插得太浅,三氧化硫气体从水中逸出,与水蒸气化和形成酸雾.
分析 (1)依据工业制硫酸的原理分析书写化学方程式;
(2)根据工业制硫酸的步骤和设备名称,结合实验装置的反应过程分析解答;
(3)O2和SO2在催化剂表面所发生反应,温度影响反应速率、化学平衡和催化剂的活性;
(4)观察甲装置导管的冒泡速率进行估算通入乙中O2和SO2的量;
(5)若丁装置在反应过程中先出现气泡,不久就出现了雾,而丙装置一直都没有任何现象,可能是SO3通入丙和丁装置中,丙中全部被吸收,丁中三氧化硫与水反应放出大量热,形成酸雾;或者丙中压强大,气体直接进入丁中.
解答 解:(1)沸腾炉内煅烧黄铁矿,反应物为FeS2和O2,生成物为Fe2O3和SO2,根据化合价升降法配平,FeS2中Fe由+2价变为+3价,S由-1价变为+4价,1molFeS2总共失去11mol电子,O2中O由O价变为为-2价,得4mol电子,所以FeS2前计量数为4,O2前计量数为11,再根据原子守恒其它物质的系数,化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(2)在装置乙中二氧化硫和氧气发生催化氧化,所以装置乙相当于接触室;丙在实验中是用来吸收二氧化硫的,所以相当于吸收塔;故答案为:接触室、吸收塔;
故答案为:接触室;吸收塔;
(3)O2和SO2在催化剂表面所发生反应,生成SO3,化学方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3;该反应是放热反应,温度升高加快反应速率,但平衡逆向移动,使得SO2转化率降低,且催化剂在一定温度内活性最大,温度过高会使催化剂丧失活性;
故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3;
该反应为放热反应,温度升高SO2转化率降低;温度过高催化剂活性降低;
(4)乙反应容器内要求氧气的量要比二氧化硫的量多一倍左右,要求氧气进入装置中的速度比二氧化硫进入装置中的速度快一倍左右,故可以通过调节气阀,控制气体流量,即观察甲装置的冒泡速率进行估算;
故答案为:可以通过调节气阀,控制气体流量,观察甲装置的冒泡速率进行估算;
(5)若丁装置在反应过程中先出现气泡,不久就出现了雾,而丙装置一直都没有任何现象,可能是SO3通入丙和丁装置中,丙中全部被吸收,丁中三氧化硫与水反应放出大量热,形成酸雾;或者丙中压强大,气体直接进入丁中,即丙中的导气管插得太深,导致两个吸收瓶内的气压差较大;
故答案为:AC.
点评 本题主要考查工业接触法制硫酸的原理,同时涉及到平衡移动、转化率等,重点考查制备过程中的注意问题和条件的选择依据,注重对知识的综合运用和迁移能力考查,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |

已知部分离子沉淀所需的pH如下表
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.7 | 7.5 | 1.4 |
| 沉淀完全pH | 6.7 | 14 | 3.7 |
(1)上述③过滤操作中除要用到玻璃棒,铁架台,烧杯等还缺的玻璃仪器有漏斗,废渣中的主要化学物质是BaSiO3、H2SiO3、Fe(OH)3、BaSO4(写化学式)
(2)写出酸溶过程中涉及氧化还原反应的离子方程式3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O
(3)该厂结合本厂实际,选用的X为BaCO3(填化学式);中和Ⅰ使溶液中Fe3+、H+(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)
(4)上述④洗涤的目的是减少废渣中可溶性钡盐对环境的污染.
(5)由于废渣给周围环境造成了一定的污染,该工厂想设计一个方案,将工厂废渣进行分离,并制备生产光导纤维的主要原材料,请你按示例简要设计实验分案(示例:取物质A$\stackrel{加热}{→}$$\stackrel{蒸发}{→}$ 得到物质B)
废渣$\stackrel{适量氢氧化钾}{→}$$\stackrel{搅拌过滤}{→}$滤液$\stackrel{加入足量盐酸}{→}$$\stackrel{搅拌过滤}{→}$$\stackrel{加热}{→}$二氧化硅.
| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 熔点:金刚石>Hg>KCl>HCl |
 同一短周期内主族元素最高价氧化物对应水化物相同浓度稀溶液的pH与原子半径的关系如图,下列说法正确的是( )
同一短周期内主族元素最高价氧化物对应水化物相同浓度稀溶液的pH与原子半径的关系如图,下列说法正确的是( )| A. | 原子序数:W>Z>X | |
| B. | 气态氢化物的稳定性:N>R | |
| C. | Y和W形成共价化合物 | |
| D. | X和Z两者最高价氧化物对应的水化物能相互反应 |

 ;G的结构简式HCOOCH3;
;G的结构简式HCOOCH3; .写出D与C反应生成A的化学方程式CH3OH+
.写出D与C反应生成A的化学方程式CH3OH+ +H2O.
+H2O.