题目内容
15.钡盐行业生产中排出大量的钡泥 主要含有【BaCO3、BaSiO3、BaSO3、Ba(FeO2)2】等.某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下
已知部分离子沉淀所需的pH如下表
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.7 | 7.5 | 1.4 |
| 沉淀完全pH | 6.7 | 14 | 3.7 |
(1)上述③过滤操作中除要用到玻璃棒,铁架台,烧杯等还缺的玻璃仪器有漏斗,废渣中的主要化学物质是BaSiO3、H2SiO3、Fe(OH)3、BaSO4(写化学式)
(2)写出酸溶过程中涉及氧化还原反应的离子方程式3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O
(3)该厂结合本厂实际,选用的X为BaCO3(填化学式);中和Ⅰ使溶液中Fe3+、H+(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)
(4)上述④洗涤的目的是减少废渣中可溶性钡盐对环境的污染.
(5)由于废渣给周围环境造成了一定的污染,该工厂想设计一个方案,将工厂废渣进行分离,并制备生产光导纤维的主要原材料,请你按示例简要设计实验分案(示例:取物质A$\stackrel{加热}{→}$$\stackrel{蒸发}{→}$ 得到物质B)
废渣$\stackrel{适量氢氧化钾}{→}$$\stackrel{搅拌过滤}{→}$滤液$\stackrel{加入足量盐酸}{→}$$\stackrel{搅拌过滤}{→}$$\stackrel{加热}{→}$二氧化硅.
分析 钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,过滤得到的固体洗涤后除去废渣,滤液重新加入酸溶步骤充分利用,
(1)依据过滤操作和装置图分析需要的玻璃仪器,依据上述分析可知,最后的废渣中除含少量的BaSiO3、H2SiO3(H4SiO4)及原有的难溶性杂质外,还含有中和Ⅰ使溶液中H+浓度减小,Fe3+形成Fe(OH)3沉淀,硝酸具有强氧化性,将亚硫酸钡氧化为硫酸钡,故沉淀中还含有Fe(OH)3、BaSO4;
(2)硝酸具有强氧化性,将亚硫酸钡氧化为硫酸钡,同时生成NO与水;
(3)X既要能中和硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;中和Ⅰ使溶液中的Fe3+形成Fe(OH)3沉淀、H+浓度减小;
(4)洗涤废渣是为了减少废渣中可溶性钡盐对环境的污染;
(5)废渣中含有BaSiO3、H2SiO3、Fe(OH)3、BaSO4,加入氢氧化钾溶液充分溶解后过滤得到硅酸钾滤液,在滤液中加入足量盐酸和剩余氢氧化钾溶液和硅酸钾充分反应,生成硅酸沉淀,过滤得到沉淀加热灼烧得到二氧化硅.
解答 解:钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,过滤得到的固体洗涤后除去废渣,滤液重新加入酸溶步骤充分利用,
(1)上述③过滤操作中除要用到玻璃棒,铁架台,烧杯等还缺的玻璃仪器有漏斗,最后的废渣中除含少量的BaSiO3、H2SiO3(H4SiO4)及原有的难溶性杂质外,中和Ⅰ使溶液中H+浓度减小,Fe3+形成Fe(OH)3沉淀,硝酸具有强氧化性,将亚硫酸钡氧化为硫酸钡,故沉淀中还含有Fe(OH)3、BaSO4,
故答案为:漏斗;BaSiO3、H2SiO3、Fe(OH)3、BaSO4;
(2)硝酸具有强氧化性,将亚硫酸钡氧化为硫酸钡,同时生成NO与水,反应离子方程式为:3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O,
故答案为:3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O;
(3)加入X调节溶液的pH=4~5,则X应能消耗H+,结合工厂主要生产BaCl2、BaCO3、BaSO4的实际情况,可选用BaCO3;中和后溶液中H+浓度减小,pH在4~5时,Fe3+也完全沉淀,故Fe3+浓度也减小,故答案为:BaCO3;Fe3+、H+;
(4)因为钡盐是重金属盐,有毒,故洗涤的目的是减少废渣中可溶性钡盐对环境的污染,故答案为:减少废渣中可溶性钡盐对环境的污染;
(5)废渣中含有BaSiO3、H2SiO3、Fe(OH)3、BaSO4,加入氢氧化钾溶液充分溶解后过滤得到硅酸钾滤液,在滤液中加入足量盐酸和剩余氢氧化钾溶液和硅酸钾充分反应,生成硅酸沉淀,过滤得到沉淀加热灼烧得到二氧化硅,设计实验方案为:废渣$\stackrel{适量氢氧化钾}{→}$$\stackrel{搅拌过滤}{→}$ 滤液$\stackrel{加入足量盐酸}{→}$ $\stackrel{搅拌过滤}{→}$ $\stackrel{加热}{→}$二氧化硅,
故答案为:废渣$\stackrel{适量氢氧化钾}{→}$$\stackrel{搅拌过滤}{→}$ 滤液$\stackrel{加入足量盐酸}{→}$ $\stackrel{搅拌过滤}{→}$ $\stackrel{加热}{→}$二氧化硅.
点评 本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,考查学生对新信息的处理能力,题目难度中等.

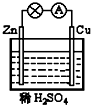
| A. | 正极反应为 Cu-2e-Cu2+ | B. | 溶液中H+向锌片移动 | ||
| C. | 电子由锌片通过导线流向铜 | D. | 该装置能将电能转化为化学能 |
| A. | 1.5mol | B. | 3mol | C. | 4.5mol | D. | 6mol |

根据以上信息回答下列问题:
(1)写出生产过程中XFe YHCl(填化学式).
(2)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液250mL于锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+.三次平行实验结果如下(平行实验结果相差不能超过1%):
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |

 为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题: ;
;