题目内容
17.下列事实不能用键能的大小来解释的是( )| A. | N元素的电负性较大,但N2的化学性质很稳定 | |
| B. | 稀有气体一般难发生反应 | |
| C. | HF比H2O稳定 | |
| D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
分析 A、单质的稳定性与分子内的化学键的键能有关;
B、稀有气体是单原子分子;
C、H-F键能大于H-O键能,HF更稳定;
D、结构相似,键能越大,物质越稳定.
解答 解:A、虽然N元素的电负性较大,但是氮气分子内有N≡N,键能大,能用键能的大小来解释,故A不选;
B、稀有气体是单原子分子,分子内不存在化学键,不能用键能的大小来解释,故B选;
C、H-F键能大于H-O键能,HF更稳定,能用键能的大小来解释,故C不选;
D、HF、HCl、HBr、HI的稳定性逐渐减弱,是它们的键能逐渐减小的原因,能用键能的大小来解释,故D不选,
故选:B.
点评 本题考查了晶体的物理性质、化学性质与共价键的关系,要注意分子间作用力不属于化学键.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
7.能在水溶液中大量共存的一组离子是( )
| A. | H+、Al3+、NO3-、SiO32- | B. | Ca2+、Fe3+、Cl-、CO32- | ||
| C. | Na+、SO42-、OH-、NO3- | D. | NH4+、OH-、Cl-、HSO3- |
8.某烯烃加氢后生成物的结构简式为 ,符合这一条件的烯烃有( )
,符合这一条件的烯烃有( )
 ,符合这一条件的烯烃有( )
,符合这一条件的烯烃有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
12. 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:
请回答下列问题.
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1;
(2)C元素的第一电离能比氧元素的第一电离能大 (填“大”或“小”);
(3)CA3分子中C原子的杂化轨道类型是sp3;
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有①③ (填序号)
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$cm3 (写出表达式即可).
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有一个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和EO两种氧化物 |
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1;
(2)C元素的第一电离能比氧元素的第一电离能大 (填“大”或“小”);
(3)CA3分子中C原子的杂化轨道类型是sp3;
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有①③ (填序号)
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$cm3 (写出表达式即可).
2.原子序数小于18的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是( )
| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
9.下列化合物不能通过化合反应获得的是( )
| A. | Fe(OH)3 | B. | Al(OH)3 | C. | HCl | D. | NaHCO3 |
7.已知同一碳原子连有两个羟基不稳定: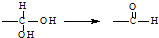 ,下列有关有机物
,下列有关有机物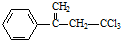 的说法不正确的是( )
的说法不正确的是( )
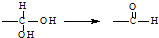 ,下列有关有机物
,下列有关有机物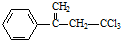 的说法不正确的是( )
的说法不正确的是( )| A. | 属于卤代烃,能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质存在顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与4molH2发生加成反应 |


 按以下步骤从
按以下步骤从 合成
合成  .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去) 、D
、D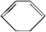 .
.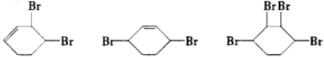 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$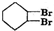 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$